
 物质A-E都是由下表中的离子组成的,常温下各物质从l mL稀释到1000mL,pH的变化如图l所示,其中A与D反应得到E.请回答:
物质A-E都是由下表中的离子组成的,常温下各物质从l mL稀释到1000mL,pH的变化如图l所示,其中A与D反应得到E.请回答:| 阳离子 |
| ||
| 阴离子 | OH-、CH3COO-、Cl- |
| 10-14 |
| 10-pH |
| 10-14 |
| 10-a |
| VB |
| VC |
| 10-(a+b) |
| 10-14 |
| 10-13 |
| 10-14 |
| 10 |
| 1 |
| 10-14 |
| 10-pH |
| 10-14 |
| 10-13 |
| 10-14 |
| 10-a |
| VB |
| VC |
| 10-(a+b) |
| 10-14 |
| 10-13 |
| 10-14 |
| 10 |
| 1 |


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
 I.科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是
I.科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是查看答案和解析>>
科目:高中化学 来源: 题型:
| 项目 | pH | Ca2+、Mg2+总浓度 | 细菌个数 |
| 相关值 | 6.5~8.5 | <0.0045mol?L-1 | <100个?mL-1 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
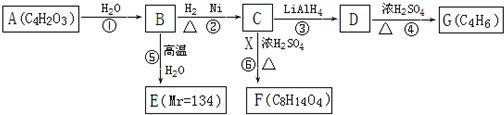

查看答案和解析>>
科目:高中化学 来源: 题型:
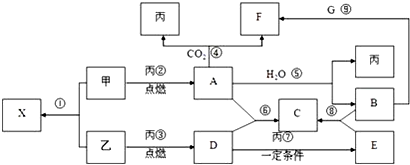
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com