
| A. | 电解过程中阴极质量不变 | |
| B. | 电解过程中溶液的pH不断升高 | |
| C. | 此时向溶液中加入适量的Ag2O固体可使溶液恢复电解前的状况 | |
| D. | 电解后两极产生的气体体积比为2:1 |
分析 用惰性电极电解AgNO3溶液,溶液中的阴离子在阳极放电,阴极离子的放电顺序为氢氧根离子>硝酸根离子;溶液中的阳离子在阴极的放电,放电顺序为银离子>氢离子,
则4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,以此来解答.
解答 解:A.电解过程中阴极银离子放电,生成单质Ag,则阴极质量增加,故A错误;
B.由4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,生成硝酸,溶液的酸性增强,pH不断降低,故B错误;
C.由电解反应可知,从溶液中析出单质Ag和氧气,则可向溶液中加入适量的Ag2O固体可使溶液恢复电解前的状况,故C正确;
D.电解时只有阳极生成氧气,在阴极上产生的是金属银,不会在阴极上产生气体,故D错误;
故选C.
点评 本题考查电解原理律,明确离子的移动方向及离子的放电顺序是解答本题的关键,难度不大.


科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:选择题
下列物质属于电解质的是 ( )
①氢氧化钾②硫酸钡③铜④蔗糖
⑤氨气⑥稀硫酸⑦熔融的KNO3
A.②⑤⑦ B.①②⑦ C.①⑥⑦ D.①⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
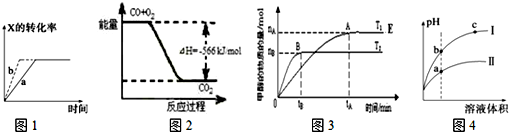
| A. | 图1所示,反应:X(g)+2Y(g)?3Z(g),b的压强一定比a大 | |
| B. | 图2表示CO生成CO2的反应过程和能量关系 | |
| C. | 图3表示反应CO+2H2?CH3OH(g),其中温度T2>T1,在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的$\frac{1}{2}$,平衡正向移动,氢气浓度增大 | |
| D. | 图4所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温恒容,充入N02气体,其转化率增大 | |
| B. | 加压,平衡向逆反应方向移动,混合气体颜色变深 | |
| C. | 若平衡常数增大,则可能是升高了温度或减小了体系的压强 | |
| D. | 当2v正(NO)=v逆(O2)时,反应达到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜的金属活动性比铁的弱,铜不能与任何强酸发生反应 | |
| B. | 浓硫酸可用作干燥剂是因为其具有强氧化性 | |
| C. | 利用Al2O3制作的坩埚,可用于熔融烧碱 | |
| D. | 制水泥和玻璃都用石灰石作原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
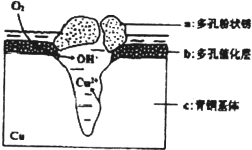 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义.
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠与盐酸反应 | B. | 氧化铁与一氧化碳在高温下反应 | ||
| C. | 氧化铜与硫酸反应 | D. | 铁粉与硫酸铜溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、X、Y、Z是前四周期的常见元素,原子序数依次增大,A可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34,请回答:
A、B、X、Y、Z是前四周期的常见元素,原子序数依次增大,A可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com