
【题目】氮的氧化物有许多重要的性质与用途,但过量排放则会导致严重的环境问题。
(1)汽车排放出的氮氧化物是导致雾霾形成的重要原因之一,汽车内安装的尾气处理器可大大降低氮氧化物的排放:2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=x kJ/mol。
已知:N2(g)+O2(g)![]() 2NO(g) ΔH=+180.50kJ/mol
2NO(g) ΔH=+180.50kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH=-566.00kJ/mol
2CO2(g) ΔH=-566.00kJ/mol
x =________________。
(2)向某恒容密闭容器中加入一定量的NO、CO并使它们之间发生反应,下图为在相同温度、压强、比表面积不同的催化剂(化学成分相同)的催化作用下,反应过程中NO的物质的量与时间之间的关系。
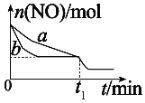
①表示催化剂比表面积较大的曲线是_________(填“a”或“b”)。
②t1min时改变(外界)的反应条件可能是____________。
(3)对于反应:mA(g)+nB(g) =pC(g)+qD(g)来说,若A、B通过一步反应能直接转化为C、D,则该反应的反应速率v=kcm(A)cn(B),其中k为只与温度有关的速率常数;若为可逆反应,则v(正)、v(逆)均存在类似的关系式,k正、k逆也只与温度有关。已知反应:2NO(g)+O2(g)![]() 2NO2(g)是通过下面两步完成的:
2NO2(g)是通过下面两步完成的:
①________________________________________(快)H1<0。
②N2O2(g)+O2(g)![]() 2NO2(g)(慢)H2<0。
2NO2(g)(慢)H2<0。
某科研小组测量出反应②的部分实验数据如下表所示:
c(N2O2)/mol/L | c(O2)/mol/L | v2正[mol/(L·s)] |
0.010 | 0.010 | 1.75 |
0.030 | 0.020 | 1.05 |
x | 0.030 | 1.05 |
i.用k2正表示②的正反应速率常数,则v2正=_________,x=_______,速率常数k2正=_______L·(mol·s)-1(填具体的数值)。
ii.在①的空白处写出化学方程式,若①②两个反应的正、逆反应速率常数分别用k1正、k1逆、k2正、k2逆表示,则2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K=____________(用速率常数表示);反应达到平衡后升高温度,在新平衡建立前,体系内c(N2O2)的大小变化情况是________。
2NO2(g)的平衡常数K=____________(用速率常数表示);反应达到平衡后升高温度,在新平衡建立前,体系内c(N2O2)的大小变化情况是________。
(4)在恒温恒容条件下,能表明2NO(g)+O2(g)![]() 2NO2(g)(只考虑总反应)己达到平衡状态的是_____________。
2NO2(g)(只考虑总反应)己达到平衡状态的是_____________。
a.混合气体密度保持不变 b.混合气体平均摩尔质量不变
c.正反应速率:v(NO)=v(NO2) d.生成NO2、O2的物质的量之比为1:2
【答案】-746.50 b 增加CO的物质的量浓度 2NO(g)![]() N2O2(g) k2正c(N2O2)c(O2) 0.02 1.75
N2O2(g) k2正c(N2O2)c(O2) 0.02 1.75![]() 10-2
10-2 ![]() 减小 b
减小 b
【解析】
(1)可用2CO(g)+O2(g)![]() 2CO2(g) ΔH=-566.00kJ/mol减去N2(g)+O2(g)
2CO2(g) ΔH=-566.00kJ/mol减去N2(g)+O2(g)![]() 2NO(g) ΔH=+180.50kJ/mol,即可求出x值为-746.50。
2NO(g) ΔH=+180.50kJ/mol,即可求出x值为-746.50。
(2)①催化剂的比表面积越大,反应物间的接触面积越大,反应速率越快,相同时间内消耗掉的反应物越多,故答案为b。
②改变反应条件的那一时刻,NO物质的量并没有改变,同时平衡向右移动且移动过程中反应速率较大,故改变的条件是加压或者增大CO的浓度。
(3)①由总反应方程式减去反应②可确定反应为2NO(g) ![]() N2O2(g);
N2O2(g);
i.根据反应速率表达式的意义可直接写出![]() ,同理也可写出其它的v正、v逆表达式。将对应数据代入后即可得k2正=1.75×10-2、x=0.02。
,同理也可写出其它的v正、v逆表达式。将对应数据代入后即可得k2正=1.75×10-2、x=0.02。
ii.设反应①的平衡常数为K1,反应②的平衡常数为K2,由反应①+②就可得到2NO(g)+O2(g)![]() 2NO2(g),故K=K1×K2。对于反应①,当反应处于平衡状态时,其正反应速率等于逆反应速率,k1正c2(NO)=k1逆c(N2O2),
2NO2(g),故K=K1×K2。对于反应①,当反应处于平衡状态时,其正反应速率等于逆反应速率,k1正c2(NO)=k1逆c(N2O2),![]() = c(N2O2)/ c2(NO)=K1,同理可推出K2=
= c(N2O2)/ c2(NO)=K1,同理可推出K2=![]() ,故K=
,故K=![]() 。因升高温度后反应①②均向左进行,但反应①速率很快而反应②速率慢,故平衡建立过程中c(N2O2)减小。
。因升高温度后反应①②均向左进行,但反应①速率很快而反应②速率慢,故平衡建立过程中c(N2O2)减小。
(4)a.反应过程中气体质量保持不变,容器容积不变,故密度是个定值,a错误;
b.由![]() 及m是定值而n不是定值知,当平均摩尔质量保持不变时,反应达到平衡,b正确;
及m是定值而n不是定值知,当平均摩尔质量保持不变时,反应达到平衡,b正确;
c.由方程式构成知NO、NO2表示的正反应速率总是相等的,c错误;
d.生成1molNO2会消耗0.5molO2,由于相同时间内消耗与生成O2的量不同,故反应没有达到平衡,d错误。
答案应选b。


科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+ 6CO(g)。
Si3N4(s)+ 6CO(g)。
(1)该反应的氧化剂是___;
(2)该反应的平衡常数表达式为K=___;
(3)若知上述反应为放热反应,升高温度,其平衡常数值___(填“增大”、“减小”或“不变”);若已知CO生成速率为v(CO)=18mol·L-1·min-1,则N2消耗速率为v(N2)=___。
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图。图中t4时引起平衡移动的条件可能是___;
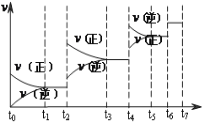
图中表示平衡混合物中CO的含量最高的一段时间是___。
(5)若该反应的平衡常数为K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2molN2充分反应,则N2的转化率是___(提示:272=729)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(52Te)被誉为“国防与尖端技术的维生素”;锡酸钠可用于制造陶瓷电容器的基体,陶瓷电容器在宇航、导弹、航海等方面有着重要的用途。以锡碲渣(主要含Na2SnO3和Na2TeO3)为原料,制备锡酸钠和碲的流程图如图:
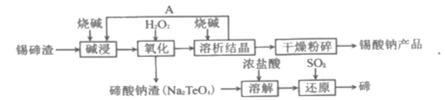
已知:锡酸钠(Na2SnO3)和亚碲酸钠(Na2TeO3)均易溶于碱。
(1)在生产过程中,要将锡碲渣粉碎,其目的是___。
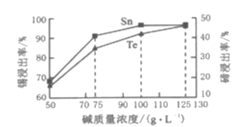
(2)“碱浸”过程中,锡碲浸出率与溶液中碱的质量浓度关系如图所示,最理想的碱的质量浓度为100g/L,其理由是___。
(3)“氧化”时,反应的离子方程式为___;“氧化”的温度控制在60℃~70℃之间,其原因是___。
(4)“还原”反应的化学方程式为___。
(5)以石墨为电极电解Na2TeO3溶液可获得Te,电解过程中阴极上的电极反应为___。
(6)常温下,向lmolL-1Na2TeO3溶液中滴加盐酸,当溶液中c(TeO32-):c(H2TeO3)=0.2时,pH=___。(已知:H2TeO3的电离平衡常数Ka1=1.0×10-3,Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取50 mL某浓度的稀硫酸与一定质量的镁、铝合金反应,合金全部溶解,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液体积的关系如图所示。求原硫酸的物质的量浓度______。
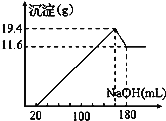
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型微生物电池可利用生活垃圾发电,其工作原理如图所示,下列有关说法中错误的是( )
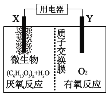
A.X电极的反应式为:(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+
B.每消耗1molO2时会有4mol质子通过质子交换膜
C.工作时外电路电流由负极流向正极
D.微生物所起作用与催化剂相当
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铜矿(主要成分为铁、铜、硫三种元素组成的化合物)为基本原料,通过一系列的冶炼可得到铜、铁、SO2、SO3、H2SO4等物质,回答下列问题:
(1)基态铁原子价层电子排布式为____________,基态硫原子的核外电子共有_______种不同的能量。硫元素所在周期的非金属元素第一电离能由大到小的顺序为__________。
(2)SO2、SO3、H2SO4中,硫原子的杂化轨道类型为sp3的物质是________,SO2的分子构型是____________,属于非极性分子的氧化物是___________。
(3)在溶液中Cu2+易与水形成[Cu(H2O)6]2+而显蓝色,向相应的溶液中加入足量的氨水可得到[Cu(NH3)4(H2O)2]2+,则[Cu(NH3)4(H2O)2]2+中Cu2+的配位数是________________,氧铜配位键与氮铜配位键相比,较稳定的是___________________。
(4)氧化铜的熔点为1326℃、沸点为1800℃;氧化亚铜的熔点为1235℃、沸点为1100℃,试解释导致这种差异最可能的原因是___________。
(5)由铁、铜、硫形成的某种化合物的晶胞是一个长方体,结构如图所示,则该化合物的化学式为____________。若晶体密度为dg·cm﹣3,则晶胞的高h=_______pm(写出简化后的计算式即可)。
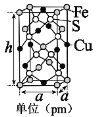
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种常用氧化剂,主要用于化工、防腐及制药工业等。可将软锰矿(主要成分为MnO2)和KClO3在碱性介质中制得K2MnO4,然后通入CO2制备高锰酸钾。已知:
温度 | 溶解度/g | ||||
K2CO3 | KHCO3 | KMnO4 | K2SO4 | CH3COOK | |
20℃ | 111 | 33.7 | 6.38 | 11.1 | 217 |
(1)制备锰酸钾的主要反应为:3MnO2+6KOH+KClO3=3K2MnO4+KCl+3H2O
①该反应中的氧化剂是_____________,还原剂是_____________。
②每生成 1mol K2MnO4转移_______ mol 电子。
(2)通入少量CO2气体时,锰酸钾发生歧化反应,生成KMnO4,MnO2,K2CO3。
①则生成的 KMnO4与MnO2的物质的量之比为__________。
②若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低,其原因是______________________________,可以把通CO2改为加其他的酸。从理论上分析,选用下列酸中_______,得到的产品纯度更高。
A.醋酸 B.浓盐酸 C.稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质结构与性质)
2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB族元素对应离子的萃取,如La3+、Sc2+。写出基态二价钪离子(Sc2+)的核外电子排布式:________,其中电子占据的轨道数为________个。
(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为________,羟基间的相互作用力为________。
(3)不同大小的苯芳烃能识别某些离子,如:![]() 、SCN-等。一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式______________________________。
、SCN-等。一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式______________________________。
(4)NH3分子在独立存在时H-N-H键角为106.7°。如图 [Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因:______。
(5)橙红色的八羰基二钴[Co2(CO)8]的熔点为52℃,可溶于乙醇、乙醚、苯等有机溶剂。该晶体属于________晶体,八羰基二钴在液氨中被金属钠还原成四羰基钴酸钠[NaCo(CO)4],四羧基钴酸钠中含有的化学键为_________________。
(6)已知C60分子结构和C60晶胞示意图(如图Ⅱ、图Ⅲ所示):

则一个C60分子中含有σ键的个数为________,C60晶体密度的计算式为________ g·cm-3。(NA为阿伏伽德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萝卜硫素(结构如图)是具有抗癌和美容效果的天然产物之一,在一些十字花科植物中含量较丰富。该物质由五种短周期元素构成,其中W、X、Y、Z的原子序数依次增大,Y、Z原子核外最外层电子数相等。下列叙述一定正确的是( )
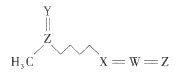
A.原子半径的大小顺序为Z>W>X>Y
B.X的简单氢化物与W的氢化物反应生成离子化合物
C.萝卜硫素中的各元素原子最外层均满足8电子稳定结构
D.Y、Z形成的二元化合物的水化物为强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com