
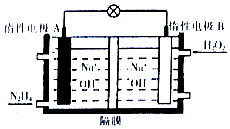
 肼(N2H4)是一种高能燃料,在工业生产中用途广泛.
肼(N2H4)是一种高能燃料,在工业生产中用途广泛.分析 (1)根据1molN2H4中有4mol的极性共价键计算;
(2)①N2H5C1类比铵盐,离子水解促进了水的电离,溶液中的氢离子就是水电离的;
②0.2mol/lN3H4溶液0.1mol/lHCl溶液等体积混合,变成了等物质的量的N3H4Cl和N3H4•H2O的混合液,根据混合溶液的pH>7判断;
(3)在加热条件下,用液态肼(N2H4)还原新制的Cu(OH)2制备Cu20,同时放出N2,结合质量守恒定律和氧化还原反应可写出此反应的化学方程式;
(4)1.6g液态N2H4的物质的量为$\frac{1.6g}{32g/mol}$=0.05mol,在上述反应中放出64.22kJ的热量,则1mol液态N2H4在上述反应中放出的热量为$\frac{64.22}{0.05}$=1284.4kJ,依此书写热化学方程式;
(5)根据反应N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)及原电池原理分析;该反应生成水,导致氢氧根离子浓度减小,溶液的pH减小.
解答 解:(1)1molN2H4中有4mol的极性共价键,所以0.5mol肼中含有2mol极性共价键,故答案为:2;
(2)①N2H6C12溶液的pH为5,N2H62+离子结合了水电离的氢氧根离子,促进了水的电离,溶液中氢离子来自水的电离,故该溶液中由水电离产生的c(H+)=10-PH=1×10-5mol/L,故该溶液中由水电离产生的c(OH-)=c(H+)=1×10-5mol/L,故答案为:1×10-5mol/L;
②0.2mol/lN3H4溶液0.1mol/lHCl溶液等体积混合,变成了等物质的量的N3H4Cl和N3H4•H2O的混合液,由于混合溶液的pH>7,则N3H4•H2O的电离大于N3H4+离子的水解,故溶液中c(N3H4+)>c(N3H4•H2O),
故答案为:>;
(3)根据反应物N2H4和Cu(OH)2,生成物是Cu20、H2O和N2,可得化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2Cu2O+6H2O,
故答案为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2Cu2O+6H2O;
(4)1.6g液态N2H4的物质的量为$\frac{1.6g}{32g/mol}$=0.05mol,在上述反应中放出64.22kJ的热量,则1mol液态N2H4在上述反应中放出的热量为$\frac{64.22}{0.05}$=1284.4kJ,故该反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1284.4 kJ/mol,
故答案为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1284.4 kJ/mol;
(5)发生反应为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g),该反应中N2H4失去电子被氧化,H2O2得到电子被还原,则燃料电池中在正极得到电子生成氢氧根离子,电极反应式为:H2O2+2e-=2OH-;
根据电极总反应可知,反应后生成氮气和水,导致电解质溶液中氢氧根离子浓度减小,溶液的pH减小,
故答案为:H2O2+2e-=2OH-;减小.
点评 本题考查较为综合,难度较大,涉及电子式、热化学方程式、化学方程式、电极反应式的书写、离子浓度大小的比较及相关物质的量浓度的计算等知识,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及综合应用用能力.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{100AB}{1000ρ-AB}$g | B. | $\frac{AB}{1000ρ-AB}×100%$g | ||
| C. | $\frac{AB}{100ρ}×100$g | D. | $\frac{100AB}{ρ-AB}$g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成Cu的物质的量是0.2mol | B. | 转移电子的物质的量是0.4mol | ||
| C. | 随着电解的进行溶液的pH减小 | D. | 阳极反应是2H2O-4e-=4H++O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
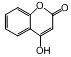 是一种医药中间体,常用来制备抗凝血药,有关该有机物的说法正确的是( )
是一种医药中间体,常用来制备抗凝血药,有关该有机物的说法正确的是( )| A. | 该有机物分子中含有4种官能团 | |
| B. | lmol该有机物最多能与5mol氢气发生加成反应 | |
| C. | 该有机物能与氯化铁溶液发生显色反应 | |
| D. | 该有机物能与氧氧化钠溶液反应,1mol有机物最多消耗2mol氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 化学式 | 相对分子质量 | 颜色 | 溶解性 |
| 三草酸合铁(Ⅲ)酸钾 | K3[Fe(C2O4)3]•3H2O | 491 | 翠绿色 | 可溶于水,难溶于乙醇 |
| 草酸亚铁 | FeC2O4•2H2O | 180 | 黄色 | 难溶于水,可溶于酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验次数 | 样品溶液体积(mL) | 滴定消耗0.100mol/L碘溶液体积(mL) |
| 1 | 20.00 | 9.80 |
| 2 | 20.00 | 10.70 |
| 3 | 20.00 | 9.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.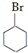 +NaOH$\stackrel{加热}{→}$
+NaOH$\stackrel{加热}{→}$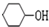 +NaBr.
+NaBr.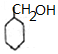 制备的合成路线.
制备的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ②④⑦ | C. | ④⑥⑦ | D. | ①③⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com