
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
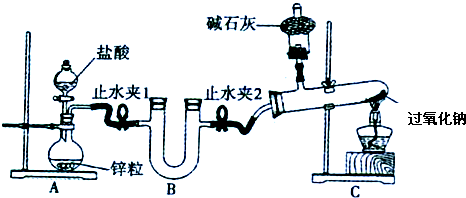
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与冷水剧烈反应而镁与冷水很难反应 | B、氢氧化铝具有两性而硅酸只具有弱酸性 | C、氯气和氢气在光照条件下反应而硫和氢气在加热条件下才能反应 | D、硫化氢水溶液呈弱酸性而氯化氢水溶液呈强酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化钠、氢氧化钠 、碳酸钠和碳酸氢钠是生活中常见的物质。
请回答下列问题。
(1)粗盐中含有可溶性CaCl2、MgCl2 Na2SO4杂质,除去这些杂质的试剂可选用
①Na2CO3、②NaOH、③BaCl2、④ HCl ,加入试剂的先后顺序可以是
(2)等质量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者 后者
(填 >、< 或 =)。
(3)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为
。
(4) 除去NaHCO3溶液中的少量Na2CO3,方法是:
离子方程式: 。
(5)钠与氢气在加热条件下能发生反应,生成一种白色固体。其中氢元素的化合价为-1价,写出白色固体与水剧烈反应生成氢气的化学方程式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com