
| A. | 加大CaCO3的量 | B. | 加大盐酸的浓度 | ||
| C. | 及时将产生的CO2导出 | D. | 减小CaCl2的浓度 |
科目:高中化学 来源: 题型:选择题
| A. | 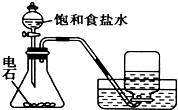 实验室制取乙炔 | B. | 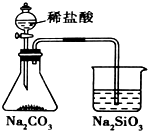 能证明非金属性Cl>C>Si | ||
| C. | 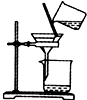 分离出Cl2与KI溶液反应生成的碘 | D. | 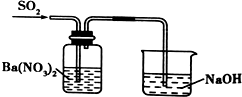 洗气瓶中产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
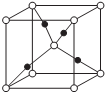 X、Y、Z、R、M是原子序数依次增大五种元素,基态X原子的s电子数比p电子数多3个,在周期表中Y与Z相邻且第一电离能Y>Z,Z、R同主族,M核外电子有29种运动状态,请回答下列问题:
X、Y、Z、R、M是原子序数依次增大五种元素,基态X原子的s电子数比p电子数多3个,在周期表中Y与Z相邻且第一电离能Y>Z,Z、R同主族,M核外电子有29种运动状态,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li和Na | B. | Rb和Ca | C. | Na和Cu | D. | K和Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相关信息 | |
| A | 所处的周期数、族序数分别与其原子序数相等 |
| B | 原子核外电子有4种不同的运动状态 |
| C | 元素原子的核外成对电子数是未成对电子数的2倍且有3个能级 |
| D | 元素原子的核外p电子数比s电子数少1 |
| E | E原子的第一至第四电离能如下: I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| F | 第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满 |
 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.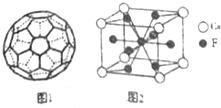
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 解释或结论 |
| A | 向某溶液中加入NaOH并微热,产生能使湿润的红色石蕊试纸变蓝的气体 | 原溶液中一定存在NH4+ |
| B | 铜粉不能溶于冷的浓硫酸 | 铜在冷的浓硫酸中发生钝化 |
| C | 往溴水中通入SO2,溶液褪色 | SO2具有还原性 |
| D | 向FeCl2溶液中通入Cl2,溶液由浅绿色变为黄色 | Cl2的氧化性比FeCl3的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
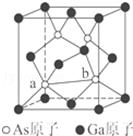 元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.请回答下列问题:
元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
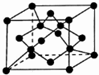 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种:1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种:1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 橙花醛不可以与溴发生加成反应 | |
| B. | 1mol橙花醛最多可以与2mol氢气发生加成反应 | |
| C. | 橙花醛可以发生银镜反应,分子结构存在顺反异构 | |
| D. | 橙花醛是乙醛的同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com