
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| A. | 少量二氧化碳通入NaClO溶液中:2NaClO+CO2+H2O→Na2CO3+2HClO | |
| B. | 过量的 HCN滴入碳酸钠溶液中 HCN+Na2CO3→NaCN+NaHCO3 | |
| C. | 结合质子能力由强到弱的顺序为:HCO3->CN->C6H5O- | |
| D. | 常温下电离常数:Ka2(H2CO3)>Ka(C6H5OH)>Ka (HCN) |
分析 相同浓度的钠盐溶液碱性越强,说明酸根离子水解程度越大,则相应酸的酸性越弱,酸的电离平衡常数越小,根据钠盐溶液的pH知,酸根离子水解程度CO32->C6H5O->CN->ClO->HCO3->CH3COO-,酸的电离平衡常数从小到大顺序是:HCO3-<C6H5OH<HCN<HClO<H2CO3<CH3COOH,据此分析解答.
解答 解:A.酸性HCO3-<HClO,所以少量二氧化碳通入NaClO溶液中发生的反应为:NaClO+CO2+H2O=NaHCO3+HClO,故A错误;
B.酸性HCO3-<HCN<H2CO3,所以过量的HCN滴入碳酸钠溶液中发生反应:HCN+Na2CO3=NaCN+NaHCO3,故B正确;
C.酸根离子水解程度越大,其结合质子能力越强,酸根离子水解程度CO32->C6H5O->CN->ClO->HCO3->CH3COO-,所以酸根离子结合质子能力大小顺序是CO32->CN->HCO3->CH3COO-,故C错误;
D.酸根离子水解程度CO32->C6H5O->CN->ClO->HCO3->CH3COO-,酸的电离平衡常数从小到大顺序是:HCO3-<C6H5OH<HCN<HClO<H2CO3<CH3COOH,故D错误;
故选B.
点评 本题考查了盐类水解,明确酸根离子水解程度与酸的电离平衡常数、相同浓度钠盐溶液pH大小的关系是解本题关键,再结合强酸制取弱酸来分析解答,题目难度中等.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H6 | B. | C2H4 | C. | C3H6 | D. | C6H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①④⑤ | C. | ①②③ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
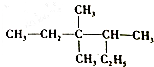
| A. | 2-乙基-3,3-二,甲基戊烷 | |
| B. | 3,3,4-三甲基己烷 | |
| C. | C的价电子轨道表示式:3,3-甲基-4乙基戊烷 | |
| D. | 2,3,3-三甲基己烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com