

| 0.042V(HCl) |
| m |
| 0.042V(HCl) |
| m |
| ||
| ||


科目:高中化学 来源: 题型:
| A、地壳中含量最多的金属元素是Al |
| B、金属一般是热和电的良导体 |
| C、自然界中绝大多数金属元素以游离态的形式存在 |
| D、金属一般呈银白色具有金属光泽 |
查看答案和解析>>
科目:高中化学 来源: 题型:
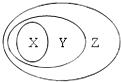 用如图表示的一些物质或概念间的从属关系中不正确的是( )
用如图表示的一些物质或概念间的从属关系中不正确的是( ) | 选项 | X | Y | Z |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 金属氧化物 | 碱性氧化物 | 氧化物 |
| D | 离子化合物 | 电解质 | 化合物 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
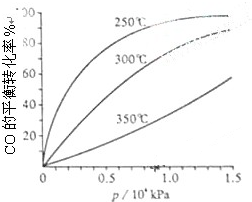 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
| B、某溶液中滴加碳酸钠溶液产生白色沉淀,说明原溶液含有Ba2+ |
| C、某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 |
| D、验证烧碱溶液中是否含有Cl-,先加足量的稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
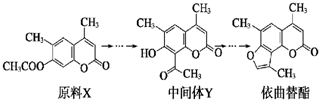
| A、原料X与中间体Y互为同分异构体 |
| B、原料X可以使酸性KMnO4溶液褪色 |
| C、中间体Y能发生加成、取代、消去反应 |
| D、1 mol依曲替酯只能与1 mol NaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,正丁烷的燃烧热为-2878.0kJ/mol |
| B、相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多 |
| C、常温下,CO的燃烧热为566.0 kJ/mol |
| D、人类利用的能源都是通过化学反应获得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
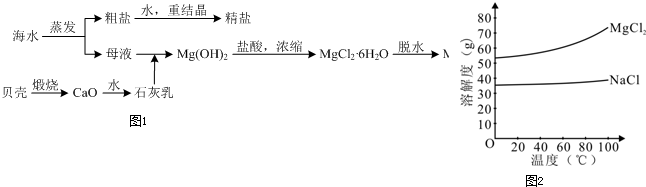
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com