
【题目】常温下下列物质中不能和水反应的是( )
A.NH3
B.SO2
C.Na
D.NO
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】粉煤灰的综合利既有利于节约资源又有利于保护环境。某粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)的铝、铁分离工艺流程如下:
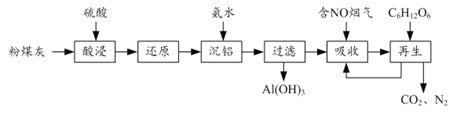
(1)①“酸浸”时Al2O3发生反应的离子方程式为______。
②当硫酸质量分数大于50%,金属氧化物浸出率明显下降。其原因是______。
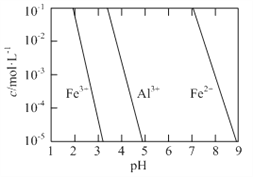
(2)有关金属离子以氢氧化物沉淀时离子浓度随pH变化如图所示。若浸出液不经还原直接与氨水混合,铝、铁元素分离效果较差的原因是______。
(3)沉铝后所得FeSO4溶液可用于烟气中NO吸收,其原理为Fe2++2NO![]() [Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
[Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
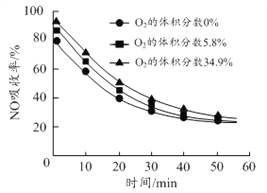
①为提高烟气中NO 的吸收率,可采取的措施有______(答一条,并说明理由)。
②“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6发生反应的离子方程式为______。
(4)Al(OH)3经过一系列反应可获得粗铝,利用熔融状态下物质密度不同,通过三层液电解精炼法可由粗铝获得高纯铝(装置如图所示)。

①该装置工作时,电极A作______极。
②熔融粗铝时加入铜的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的叙述错误的是( )
A.过滤操作中,漏斗的尖端应接触烧杯内壁
B.从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁
C.做钠的燃烧实验,可将金属钠放在坩埚里
D.向容量瓶转移液体时,导流用玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室研究潜水艇中供氧体系反应机理的装置图(夹持仪器略)。
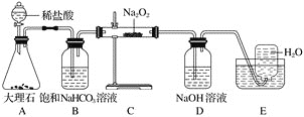
(1)A装置为CO2的发生装置,反应的离子方程式为____________________。
(2)B装置可除去A装置中可能挥发出的___________,反应的离子方程式为_______________。
(3)C装置为O2的发生装置,反应的化学方程式为__________________、________________。
(4)D装置可除去C装置中未反应的__________,反应的离子方程式为____________________。
(5)E装置为排水法收集O2的装置,检验所收集的气体为O2的方法为_____________________。
(6)C装置中固体由淡黄色完全变为白色,检验固体成分的实验方案为取少量C装置中反应后的固体溶于水,向溶液中滴入过量___溶液,若有白色沉淀生成,则证明固体中含有___;过滤,向滤液中滴入几滴酚酞溶液,若__且不褪色,则证明固体中含有__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取 CH3CH2Cl 最好的方法是( )
A.乙烷与氯气发生取代反应B.乙烯与氯气发生加成反应
C.乙烷与 HCl 发生取代反应D.乙烯与 HCl 发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用一种试剂就可以鉴别乙醇、乙酸溶液、葡萄糖溶液,这种试剂是
A. NaOH溶液 B. Na2CO3溶液
C. 石蕊试液 D. Cu(OH)2悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,不能按 ![]() (“―→”表示反应一步完成)关系转化的是( )
(“―→”表示反应一步完成)关系转化的是( )
选项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | AlCl3 | Al(OH)3 | NaAlO2 |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,几种弱酸的电离平衡常数如下表所示,下列说法正确的是
化学式 | HCOOH | H2CO3 | HCN |
电离平衡常数 | K=1.8×10-4 | K1=4.3×10-7 K2=5.6×10-11 | K=4.9×10-10 |
A. H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+CN-==HCO3-+HCN
B. HCOOH的电离平衡常数表达式为K= c(HCOOH)/[c(HCOO-)·c(H+)]
C. Na2CO3溶液显碱性,NaHCO3溶液显酸性
D. 酸性强弱顺序是HCOOH>HCN>H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 标准状况下,22.4L 氦气与 1mol氢气所含原子数均为 2NA
B. 25 ℃、1.01×105Pa时,2.24 L Cl2中含有的原子数为0.2×6.02×1023
C. 常温常压下,S2和S8的混合物共6.4 g,所含硫原子数一定为0.2 NA
D. 将100 mL 0.1 molL﹣1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com