
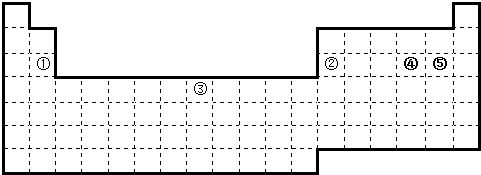
分析 (1)金属元素与非金属元素的分界线位于B~Al、Si~Ge、As~Sb、Te~Po之间;
(2)根据元素①与元素②在周期表中的位置可知元素①为Mg、元素②为Al,结合元素周期律知识进行判断;
(3)元素③的原子序数为26,为铁元素,位于第四周期Ⅷ族,铁原子核外电子总数为26,结合构造原理形成其价电子排布式;
(4)X原子在第二电子层上只有一个空轨道,则价层电子排布式为2s22p2,则X是C元素;元素④为S、元素⑤为Cl元素,则Z为二硫化碳、W为四氯化碳,二硫化碳为直线型结构、四氯化碳为非极性分子.
解答 解:(1)金属元素与非金属元素的分界线位于B~Al、Si~Ge、As~Sb、Te~Po之间,可表示为: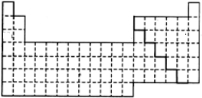 ,
,
故答案为: ;
;
(2)元素①与元素②在周期表中的位置可知元素①为Mg、元素②为Al,
A.二者位于同一周期,原子序数越大,原子半径影响,则原子半径大小为:①>②,故A错误;
B.金属性越强,电负性越小,金属性:Mg>Al,则二者的电负性大小为:②>①,故B正确;
C.金属性越强,第一电离能越小,金属性:Mg>Al,则第一电离能大小为:①<②,故C正确;
D.同一周期中,原子序数越大,金属性越弱,则金属性大小为:①>②,故D错误;
故答案为:BC;
(3)根据图示可知,元素③的原子序数为26,位于第四周期Ⅷ族,为Fe元素,铁原子核外电子总数为26,其价电子排布式为:3d64s2,
故答案为:3d64s2;
(4)X原子在第二电子层上只有一个空轨道,则价层电子排布式为2s22p2,则X是C元素;
元素④为S、元素⑤为Cl元素,则Z为二硫化碳、W为四氯化碳,二硫化碳为直线型结构,其分子中C原子采用sp杂化;四氯化碳为正四面体结构,属于极性键形成的非极性分子,
故答案为:C;sp;非极性.
点评 本题考查了位置、结构与性质的关系,题目难度中等,熟练掌握原子结构与元素周期表、元素周期律的关系为解答关键,试题培养了学生灵活应用基础知识的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 硝酸钠、NaNO2、盐 | B. | 氧化铁、FeO、氧化物 | ||
| C. | 纯碱、Na2CO3、碱 | D. | 酒精、CH3CH2OH、有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;E的分子式为C10H12O2;F中含氧官能团的名称是酯基、醛基.
;E的分子式为C10H12O2;F中含氧官能团的名称是酯基、醛基. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度可以加快反应速率 | |
| B. | 使用合适的催化剂可以加快反应的速率 | |
| C. | 在上述条件下,氢气能全部转化为氨气 | |
| D. | 达到平衡时,体系中各物质的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加成反应,消去反应,取代反应 | B. | 消去反应,加成反应,取代反应 | ||
| C. | 取代反应,消去反应,加成反应 | D. | 取代反应,加成反应,消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:回答下列问题:
(具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:回答下列问题:
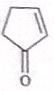 ,E的结构简式为
,E的结构简式为 .
.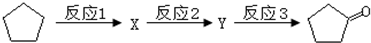
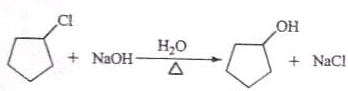 :反应3可用的试剂为O2/Cu.
:反应3可用的试剂为O2/Cu.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
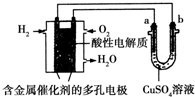
| A. | 此装置用于铁表面镀铜时,a为铁 | |
| B. | 此装置用于电镀铜时,硫酸铜溶液的浓度减小 | |
| C. | 燃料电池中正极反应为$\frac{1}{2}$O2+2e-+H2O═2OH- | |
| D. | 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com