
| | A | B | C | D |
| 正极 | Zn | Cu | Zn | Fe |
| 负极 | Cu | Zn | A g | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | CuCl2 |
科目:高中化学 来源:不详 题型:单选题

| A.①②③ | B.③④⑤ | C.④⑤⑥ | D.②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | A | B | C | D |
| 正极 | Zn | Ag | Cu | Cu |
| 负极 | Cu | Cu | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | FeCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
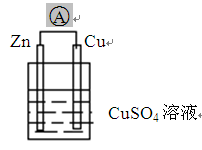
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.增加6.5 g | B.减少6.5 g | C.增加21.6g | D.减少21.6g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
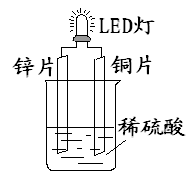
| A.铜片表面有气泡生成 |
| B.装置中存在“化学能→ 电能→ 光能”的转换 |
| C.如果将硫酸换成柠檬汁,导线中不会有电子流动 |
| D.如果将锌片换成铁片,电路中的电流方向不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
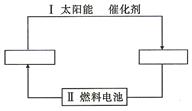
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应①、②中电子转移数目相等 |
| B.反应①中氧化剂是氧气和水 |
| C.与铜质水龙头连接处的钢质水管不易发生腐蚀 |
| D.钢铁在潮湿的空气中不能发生电化学腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com