
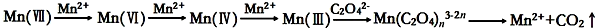
| 实验编号 | 烧杯中所加试剂及用量(mL) | 控制 条件 | 溶液褪色时间(S) | |||
| 0.10mol/LH2C2O4 溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | 18 | |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65° | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5mL0.10mol/LK2SO4 | 18 |
分析 [提出假设]草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,而随反应进行,浓度减小;
[设计、完成实验](1)结合m=cVM计算;
①称量固体质量需要托盘天平,配制溶液需要容量瓶;
②结合c=$\frac{n}{V}$及不当操作对n、V的影响分析浓度变化;
(2)由控制变量法可知,实验3、4中只有催化剂不同,其它均相同,可说明生成的Mn2+对该反应有催化作用,反应速率加快;
(3)草酸溶液与酸性KMnO4溶液发生氧化还原反应,反应生成Mn2+、CO2、H2O,结合离子反应方程式计算KMnO4溶液的物质的量浓度.
解答 解:[提出假设]草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,因为随反应进行,反应物浓度降低,反应速率减慢,则探究反应过程中使褪色加快的主要原因不考虑浓度的影响,故答案为:反应物浓度降低,反应速率减慢;
[设计、完成实验](1)草酸晶体的质量为0.5L×0.1mol/L×126g/mol=6.3g,故答案为:6.3;
①称量固体质量需要托盘天平,配制溶液需要容量瓶,则配制溶液必须用到的2种定量仪器是托盘天平和500mL容量瓶,故答案为:500mL容量瓶;
②A.称取草酸晶体时,将草酸晶体放在托盘天平右盘,晶体质量偏小,则n偏小,所配溶液浓度偏低,故A选;
B.定容时俯视刻度线,水加少,V偏小,则所配溶液浓度偏高,故B不选;
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水,对实验无影响,所配溶液浓度不变,故C不选;
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容,则V偏大,所配溶液浓度偏低,故D选;
故答案为:AD;
(2)由控制变量法可知,实验3、4中只有催化剂不同,其它均相同,则x=30-5=25,可说明生成的Mn2+对该反应有催化作用,反应速率加快,故答案为:25;
(3)草酸溶液与酸性KMnO4溶液发生氧化还原反应,反应生成Mn2+、CO2、H2O,离子反应为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,n(H2C2O4)=0.01L×0.10mol/L=0.001mol,由离子反应方程式可知KMnO4溶液的物质的量浓度为$\frac{0.001mol×\frac{2}{5}}{0.04L}$=0.010mol/L,故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;0.010mol/L.
点评 本题考查影响反应速率的因素及溶液配制、浓度计算等,为高频考点,把握反应速率的影响因素、控制变量法及离子反应的计算为解答的关键,侧重分析与实验能力的综合考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 .
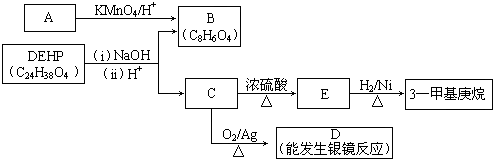
.
 .
. .
.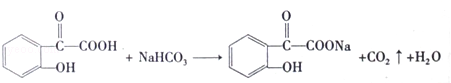 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熟石膏的化学式:2CaSO4•H2O | B. | 明矾的化学式KAlSO4•12H2O | ||
| C. | CaCl2的电子式: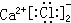 | D. | 氯化钠的电子式Na:$\underset{\stackrel{..}{Cl}}{..}$: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
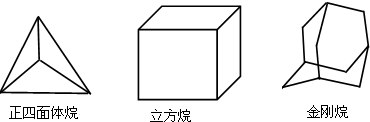 科学研究发现,具有高度对称性的有机分子具有致密性高,稳定性强,张力能大等特点,因此这些分子成为2014年化学界关注的热点,下面是几种常见高度对称烷烃的分子碳架结构这三种烷烃的二氯取代产物的同分异构体数目是( )
科学研究发现,具有高度对称性的有机分子具有致密性高,稳定性强,张力能大等特点,因此这些分子成为2014年化学界关注的热点,下面是几种常见高度对称烷烃的分子碳架结构这三种烷烃的二氯取代产物的同分异构体数目是( )| A. | 2种4种 8种 | B. | 2种4种6种 | C. | 1种3种6种 | D. | 1种3种 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银氨溶液中:Na+,H+,NO3- | B. | 碘化钾溶液中:H+,H2O,SO32- | ||
| C. | 偏铝酸钠溶液中:K+,Cl-,SO42- | D. | 氢氧化钙溶液中:Na+,ClO-,HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3(AgNO3) | B. | NaOH(NaOH) | C. | KCl(KCl) | D. | CuSO4(CuO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以H2为燃料的新型燃料电池,电池的工作示意图所示.若此电池以KOH为电解质溶液,试回答下列问题:
以H2为燃料的新型燃料电池,电池的工作示意图所示.若此电池以KOH为电解质溶液,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com