
分析 根据热化学方程式的书写方法可知,物质的物质的量与反应放出的热量成正比,并注意标明各物质的聚集状态来解答;写出热化学方程式,根据盖斯定律来分析.
解答 解:0.5mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出1082.5 kJ热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2×1082.5 kJ=2165KJ的热量,反应的热化学方程式为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165 kJ•mol-1;
由于①B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol,②H2O(l)→H2O(g);△H=+44kJ/moL,由盖斯定律可知①+②×3得:B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2033kJ/mol,11.2L(标准状况)即0.5mol乙硼烷完全燃烧生成气态水时放出的热量是2033kJ×0.5=1016.5kJ,
故答案为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol;1016.5.
点评 本题考查了热化学方程式的书写方法和盖斯定律的计算应用以及热量的计算,需要注意的有:反应热的数值与化学方程式前面的系数成正比.题目难度中等.


科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
| A. | 甲中反应的平衡常数小于乙 | |
| B. | 该温度下,该反应的平衡常数K为400 | |
| C. | SO2的平衡转化率:α1>α2=α3 | |
| D. | 容器中SO3的物质的量浓度:丙=丁<甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
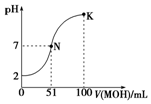 常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
| 醋酸浓度(mol•L-1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的铜与浓硝酸反应有一氧化氮生成 | |
| B. | Al、Fe、Cu的单质放置在空气中均只生成氧化物 | |
| C. | SiO2与酸、碱均不反应 | |
| D. | 向一定浓度的Na2SiO3溶液中通入适量CO2气体,出现白色沉淀,则H2SiO3的酸性比H2CO3的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 腐乳是桂林有名的特产之一,请参考图中的有关信息回答下列问题.
腐乳是桂林有名的特产之一,请参考图中的有关信息回答下列问题.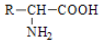 .腐乳虽好但不能作为主食,原因在于腐乳所含的糖类营养素较少,而该类营养素是人类生命活动所需能量的主要来源物质.
.腐乳虽好但不能作为主食,原因在于腐乳所含的糖类营养素较少,而该类营养素是人类生命活动所需能量的主要来源物质. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com