
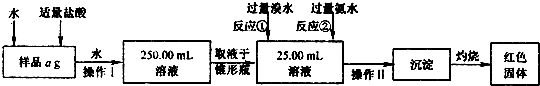

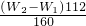 ,250ml中含有铁元素质量
,250ml中含有铁元素质量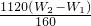 ;所以铁元素质量分数=
;所以铁元素质量分数=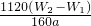 ×100%=
×100%=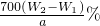 ,故答案为:
,故答案为: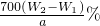 ;
;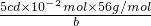 ×100%=
×100%=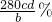 ;
;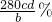 ;偏大;
;偏大;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成为 ①氢气 ①氢气 |
| 实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤, 加入足量 ②稀盐酸 ②稀盐酸 |
③产生气体沉淀全部溶解 ③产生气体沉淀全部溶解 |
白色不溶物可能是MgCO3 |
| 实验Ⅳ | 取实验Ⅰ中的澄清溶液, 向其中加入少量稀CaCl2溶液 |
产生白色沉淀 | 溶液中存在 ④CO32- ④CO32- |
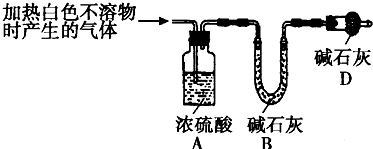
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
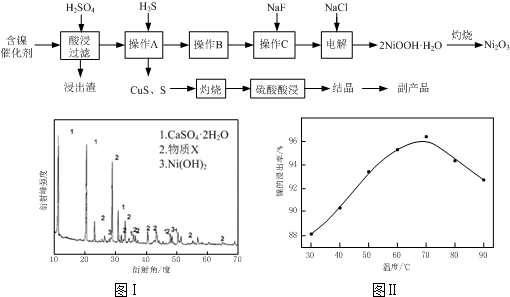
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:
(2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:| 装置 | A (试管+粉末) |
B | C |
| 反应前 | 42.0g | 75.0g | 140.0g |
| 反应后 | 37.0g | 79.0g | 140.5g |
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
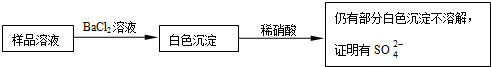
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com