
| A、乙烯的结构简式:C2 H4 | ||||
B、NaHS的电子式:Na+[H:
| ||||
| C、S2Cl2的结构式Cl-S-S-Cl | ||||
| D、氯化钠的分子式:NaCl |
| ||
| ?? |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A | B | C | D | |
| 强电解质 | NaCl | H2SO4 | CaCO3 | HNO3 |
| 弱电解质 | HF | BaSO4 | Fe(SCN)3 | HBr |
| 非电解质 | Cu | CO2 | NH3 | SO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强氧化剂与强还原剂一定能发生氧化还原反应 |
| B、为提高KMnO4溶液的氧化能力,用盐酸将KMnO4溶液酸化 |
| C、5mL98%的浓硫酸加水稀释至50mL,硫酸的质量分数大于9.8% |
| D、1molCl2参加化学反应获得的电子数都是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电子数是166 |
| B、中子数是99 |
| C、质量数是67 |
| D、原子序数是166 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定 |
| B、某病人静脉滴注生理盐水后,血液被稀释,会导致c(H+)显著减小,pH显著增大,可能会引起碱中毒 |
| C、当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定 |
| D、在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH略减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离的c(H+):①=②>③=④ |
| B、将①、④两种溶液混合后,若pH=7,则消耗溶液的体积:①>④ |
| C、①②的导电性不同,③④的导电性也不同 |
| D、向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
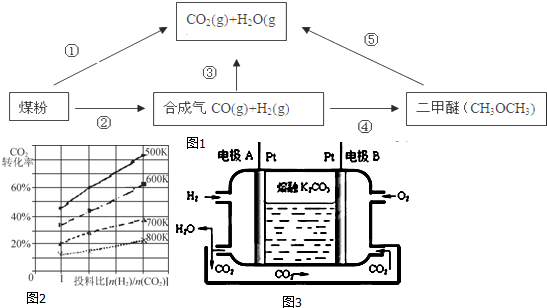
| 催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com