
| A. | 分子中一定含有共价键 | B. | 共价化合物中可能含有离子键 | ||
| C. | 离子化合物中可能含有共价键 | D. | 离子化合物中只含有离子键 |
分析 A、稀有气体分子中不含有化学键;
B、含有离子键的化合物一定是离子化合物;
C、离子化合物中也可能含有共价键;
D、离子化合物中也可能含有共价键.
解答 解:A、稀有气体是单原子分子,所以不存在化学键,只存在分子间作用力,故A错误;
B、含有离子键的化合物一定是离子化合物,共价化合物中一定不含离子键,故B错误;
C、含有离子键的化合物一定是离子化合物,离子化合物中也可能含有共价键,如NaOH,故C正确;
D、离子化合物中可能含有共价键,如NaOH,故D错误;
故选C.
点评 本题考查了学生对化学键的辨别能力,难度不大,一般活泼金属和活泼非金属易形成离子键,非金属间易形成共价键,离子化合物中可能含有共价键,共价化合物中一定不含离子键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
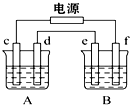 如图,A池用石墨电极电解饱和KCl溶液,B池精炼粗铜,当d极产生具有氧化性的气体在标准状况下为2.24L时停止通电,此时A池中KCl有剩余且溶液的体积为200mL,下列说法正确的是( )
如图,A池用石墨电极电解饱和KCl溶液,B池精炼粗铜,当d极产生具有氧化性的气体在标准状况下为2.24L时停止通电,此时A池中KCl有剩余且溶液的体积为200mL,下列说法正确的是( )| A. | 向A池中通入4.48 L HCl气体可恢复到电解前的状态 | |
| B. | 停止通电后恢复至室温A池中溶液的pH值为14 | |
| C. | 电极e应为粗铜板材料且质量减少6.4 g | |
| D. | 该电路中通过的电子的物质的量为0.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
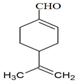 +2Ag[(NH3)2]OH
+2Ag[(NH3)2]OH
 +2Ag+3NH3+H2O
+2Ag+3NH3+H2O ,通过类似反应柠檬烯可由一种有机物合成得到,该有机物的结构简式为
,通过类似反应柠檬烯可由一种有机物合成得到,该有机物的结构简式为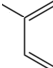 .
.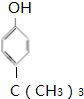 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应 | |
| B. | 除去甲烷气体中的乙烯可以将混合气体通过盛有足量酸性高锰酸钾溶液的洗气瓶 | |
| C. | 苯的二氯代物有3种,说明苯分子是由6个碳原子以单双键交替结合而成的六元环 | |
| D. | 乙酸和乙醇在浓硫酸作用下可以反应,该反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
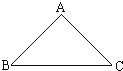 物质间的三角转化关系是化学中常见关系,如图所示,已知A、B、C都含有同一种元素X,且A、B、C之间可以相互转化.
物质间的三角转化关系是化学中常见关系,如图所示,已知A、B、C都含有同一种元素X,且A、B、C之间可以相互转化. ,B的俗名是小苏打.
,B的俗名是小苏打.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在100℃、101 kPa条件下,1 mol液态水汽化时需要吸收40.69 kJ的热量,则H2O(g)═H2O(l)的△H=+40.69 kJ•mol-1 | |
| B. | 已知CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-802.33 kJ•mol-1,则CH4的燃烧热为802.33 kJ | |
| C. | 稀硫酸与0.1 mol•L-1NaOH溶液反应的热化学方程式为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1 | |
| D. | 已知S(g)+O2(g)═SO2(s)△H1,S(g)+O2(g)═SO2(g)△H2,则△H2<△H1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com