
| A、复分解反应 |
| B、置换反应 |
| C、氧化还原反应 |
| D、离子反应 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、 |
| B、CH2=CH2+Cl2+Ca(OH)2→CH2-CH2+CaCl2+H2O |
C、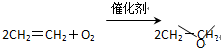 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na与水反应时增大水的用量 |
| B、将铝片改为铝粉,做铝与氧气反应的实验 |
| C、在K2SO4与BaCl2两溶液反应时,增大压强 |
| D、Fe与稀硫酸反应制取氢气时,改用浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热 |
| B、将稀硫酸改成98%的浓硫酸 |
| C、滴加少量CuSO4溶液 |
| D、不用铁片,改用铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、构成分子晶体的微粒一定含有共价键 |
| B、完全由非金属元素组成的化合物不一定是共价化合物 |
| C、H2O是一种非常稳定的化合物,这是由于氢键所致 |
| D、所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物 质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、任何可逆反应都有一定的限度 |
| B、化学反应达到限度时,正逆反应速率相等 |
| C、化学反应的限度是不可改变的 |
| D、化学反应的限度与时间的长短无关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com