
【题目】电解质溶液中存在多种平衡。请回答下列问题:
(1)已知:
化学式 | CH3COOH | HClO |
电离常数(25℃) | 1.8×10-5 | 3.0×10-8 |
物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者C(H+)的大小:a______b(填“>”、“<”或“=”)。
(2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的 __________(填字母)。
A. c(H+) B.  C. c(H+)·c(OH-)
C. c(H+)·c(OH-)
(3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= -lgC(H+),则:

①25℃时,醋酸的电离常数________HX的电离常数。(填“>”、“<”或“=”)
②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)________ HX溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
【答案】> B < <
【解析】
(1)相同浓度下,电离平衡常数越大,酸的电离程度越大,溶液酸性越强;
(2)常温下,将CH3COOH 溶液加水稀释过程中,c(H+)、c(CH3COO-)均减小;
(3)①稀释过程中较弱酸电离程度增大程度大,因此等pH的酸溶液稀释过程中较弱酸的氢离子浓度一直大于较强酸的氢离子浓度;
②根据酸溶液中氢离子浓度越大对水的抑制能力越强,分析判断。
(1)根据题意知,CH3COOH的电离平衡常数比HClO大,故CH3COOH的酸性比HClO的酸性强,则物质的量浓度均为0.1mol/L CH3COOH和HClO溶液中,二者c(H+)的大小关系为:a>b;
故答案为:>;
(2)常温下,将CH3COOH 溶液加水稀释过程中,c(H+)、c(CH3COO-)均减小,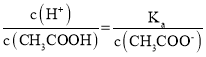 ,则
,则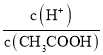 增大;c(H+)·c(OH-)=Kw,温度不变,其值不变;
增大;c(H+)·c(OH-)=Kw,温度不变,其值不变;
故答案为:B;
(3)①稀释过程中较弱酸电离程度增大程度大,因此等pH的酸溶液稀释过程中较弱酸的氢离子浓度一直大于较强酸的氢离子浓度,稀释相同的倍数,HX的pH的变化比CH3COOH的大,故HX酸性强,电离平衡常数大,则25℃时,醋酸的电离常数小于HX的电离常数;
故答案为:<;
②稀释100倍后,醋酸溶液中氢离子浓度大于HX溶液中的氢离子浓度,故对水的抑制能力也比较强,则醋酸溶液中由水电离出的 c(H+)<HX溶液中由水电离出的c(H+);
故答案为:<。


 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】由有机物 a 制备有机物 d 的合成路线如图所示。下列说法正确的是( )

A.a 中的所有原子处于同一平面
B.b 的分子式为C10H12,是乙烯的同系物
C.a 的一氯代物有 3 种,d 的一氯代物有 4 种
D.a、b 均可与酸性高锰酸钾溶液反应,c 与 d 互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)写出下列元素的名称:A_____,B_____,C_____,D_____。
(2)D元素位于周期表中____周期_____族。D2-的结构示意图是____。
(3)AB2是___(填“共价”或“离子”)化合物,C2B2所含化学键的类型是___、___。写出AB2与C2B2反应的化学方程式:___________________。
(4)用电子式表示化合物C2D的形成过程:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
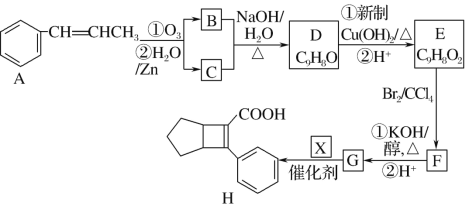
【题目】化合物G是一种有机材料的中间体。 实验室由芳香化合物A制备G的一种合成路线如下:
已知 ①
![]() RCHO + R′CHO
RCHO + R′CHO
②RCHO+R′CH2CHO ![]()
![]() + H2O
+ H2O
请回答下列问题:
(1)芳香化合物B的分子式为 _______
(2)D的官能团名称_______
(3)由D生成E的第①步反应类型为______。
(4)写出F生成G的第①步反应的化学方程式______。
(5)G与乙醇发生酯化反应生成化合物Y,Y有多种同分异构体,其中符合下列条件的同 分异构体有____种
①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2;
②其核磁共振氢谱显示有4种不同化学环境的氢,且峰面积之比为6∶2∶1∶1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用如图装置对所制备的气体进行除杂、检验,其设计方案合理的是( )
制备气体 | X(除杂试剂) | Y(检验试剂) |
| |
A | 生石灰与浓氨水 | 浓硫酸 | 红色石蕊试纸 | |
B | 电石与NaC1水溶液 | H2O | Br2的CCl4溶液 | |
C | C2H5OH与浓硫酸加热至170℃ | 饱和NaHSO3溶液 | K2Cr2O7酸性溶液 | |
D | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,发生反应:3A(g)+B(g)![]() 2C(g)△H=-QkJ/mol在3个密闭容器中,按下列方式投入反应物:
2C(g)△H=-QkJ/mol在3个密闭容器中,按下列方式投入反应物:
Ⅰ.3molA,1molB;Ⅱ.6molA,2molB;Ⅲ.4molC
则在保持恒温恒容反应达到平衡时,下列选项正确的是( )
A.容器Ⅰ与容器Ⅱ中,C的浓度2cⅠ<cⅡ,平衡常数KⅠ=KⅡ,转化率aⅠ>aⅡ
B.容器Ⅰ与容器Ⅲ中,B的体积分数vⅠ%>vⅢ%,反应的能量变化2QⅠ=QⅢ,平衡常数KⅠ2=![]()
C.容器Ⅱ与容器Ⅲ为等效平衡,B的体积分数VⅡ%=VⅢ%,转化率aⅢ+aⅡ=1,反应的能量变化QⅡ+QⅢ=Q
D.容器Ⅰ容器Ⅱ容器Ⅲ中,平衡常数关系为:KⅠ2=KⅡ=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的原子结构特点如表,下列叙述中正确的是( )
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 共用三对电子形成双原子分子,常温下为气体单质 |
A.W原子结构示意图为![]()
B.元素X和Y只能形成原子个数比为1∶2的化合物
C.元素X比元素Z的非金属性强
D.X、Y、Z、W四种元素不能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]() =1000Vρ/(17V+22400)
=1000Vρ/(17V+22400)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com