
| Fe3+ | Fe2+ | Cu2+ | |
| ĒāŃõ»ÆĪļæŖŹ¼³ĮµķŹ±µÄ pH | 1.9 | 7.0 | 4.7 |
| ĒāŃõ»ÆĪļĶźČ«³ĮµķŹ±µÄ pH | 3.0 | 9.0 | 6.7 |
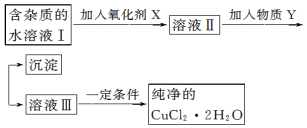
·ÖĪö ĀČ»ÆŃĒĢśŗĶĀČ»ÆĶµÄ»ģŗĻŅŗÖŠ£¬¼ÓČėŃõ»Æ¼ĮæÉŅŌ½«ŃĒĢśĄė×ÓŃõ»ÆĪŖĢśĄė×Ó£¬µ÷½ŚpHæÉŅŌ½«ĢśĄė×Ó³Įµķ£¬µĆµ½ĀČ»ÆĶµÄĖ®ČÜŅŗ£¬Č»ŗóŌŁĖįŠŌ»·¾³ĻĀÕō·¢ÅØĖõ”¢ĄäČ“½į¾§£¬¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ¼“æɵƵ½ĀČ»ÆĶ¾§Ģ壬
£Ø1£©µ±c£ØFe3+£©=10-5mol/LŹ±£¬ČĻĪŖ³ĮµķĶźČ«£¬“ĖŹ±pH=4£¬¼“c£ØOH-£©=1”Į10-10£¬øł¾ŻKsp=c£ØFe3+£©•c3£ØOH-£©¼ĘĖć£»
£Ø2£©¼ÓČėŃõ»Æ¼Į£¬½«Fe2+Ńõ»ÆĪŖFe3+£¬Ņ׳żČ„£¬¾Ż“Ė»Ų“š£»
£Ø3£©Ń”ŌńµÄŃõ»Æ¼Į²»ÄÜŅż½ųŠĀµÄŌÓÖŹĄė×ÓŹĒ×ī¼ŃŃõ»Æ¼Į£»
£Ø4£©ŌŚµ÷½ŚpHŹ±£¬¼ÓČėµÄĪļÖŹ²»ÄÜŅż½ųŠĀŌÓÖŹ£»
£Ø5£©±„ŗĶĀČ»ÆĢśČÜŅŗÖŠĢśĄė×ÓĖ®½ā³ŹĖįŠŌ£¬¼ÓČėĢ¼ĖįøĘ·ŪÄ©£¬Ģ¼ĖįøĘÓėĖį·“Ӧɜ³É¶žŃõ»ÆĢ¼ĘųĢ壬Ķ¬ŹĒ“Ł½ųĢśĄė×ÓµÄĖ®½ā¶ų²śÉśĒāŃõ»ÆĢś³Įµķ£®
½ā“š ½ā£ŗøł¾ŻĮ÷³ĢĶ¼£¬ĀČ»ÆŃĒĢśŗĶĀČ»ÆĶµÄ»ģŗĻŅŗÖŠ£¬¼ÓČėŃõ»Æ¼ĮæÉŅŌ½«ŃĒĢśĄė×ÓŃõ»ÆĪŖĢśĄė×Ó£¬µ÷½ŚpHæÉŅŌ½«ĢśĄė×Ó³Įµķ£¬µĆµ½ĀČ»ÆĶµÄĖ®ČÜŅŗ£¬Č»ŗóŌŁĖįŠŌ»·¾³ĻĀÕō·¢ÅØĖõ”¢ĄäČ“½į¾§£¬¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ¼“æɵƵ½ĀČ»ÆĶ¾§Ģ壬
£Ø1£©µ±c£ØFe3+£©=10-5mol/LŹ±£¬ČĻĪŖ³ĮµķĶźČ«£¬“ĖŹ±pH=3£¬¼“c£ØOH-£©=1”Į10-11£¬Ksp=c£ØFe3+£©•c3£ØOH-£©=10-5”Į£Ø1”Į10-11£©3=1”Į10-38£Ømol•L-1£©4£¬
¹Ź“š°øĪŖ£ŗ10-38£Ømol•L-1£©4£»
£Ø2£©øł¾ŻŹµŃéÄæµÄ£¬¼ÓČėŃõ»Æ¼ĮµÄÄæµÄŹĒ½«Fe2+Ńõ»Æ³ÉFe3+£¬±ćÓŚÉś³ÉFe£ØOH£©3³Įµķ¶ųÓėCu2+·ÖĄė£¬
¹Ź“š°øĪŖ£ŗ½«Fe2+Ńõ»Æ³ÉFe3+£¬±ćÓŚÉś³É³ĮµķÓėCu2+·ÖĄė£»
£Ø3£©K2Cr2O7”¢NaClO”¢H2O2”¢KMnO4¶¼¾ßÓŠŃõ»ÆŠŌ£¬Äܽ«ŃĒĢśĄė×ÓŃõ»Æ£¬µ«ŹĒK2Cr2O7”¢HNO3”¢KMnO4ÄÜŅż½ųŠĀµÄŌÓÖŹĄė×Ó£¬Ė«ŃõĖ®ŹĒĀĢÉ«Ńõ»Æ¼Į£¬µĆµ½µÄ»¹Ō²śĪļŹĒĖ®£¬²»»įŅż½ųŌÓÖŹĄė×Ó£¬
¹Ź“š°øĪŖ£ŗC£»
£Ø4£©ÖŠŗĶČÜŅŗµÄĖįŠŌ£¬µ÷½ŚpH£¬½«ĢśĄė×Ó³Įµķ£¬ĶĄė×Ó²»³Įµķ£¬æÉŅŌ¼ÓČėCuO[»ņCu£ØOH£©2”¢CuCO3”¢Cu2£ØOH£©2CO3£©£¬
¹Ź“š°øĪŖ£ŗCuO£Ø»ņCu£ØOH£©2”¢CuCO3”¢Cu2£ØOH£©2CO3£©£»
£Ø5£©±„ŗĶĀČ»ÆĢśČÜŅŗÖŠĢśĄė×ÓĖ®½ā³ŹĖįŠŌ£¬¼ÓČėĢ¼ĖįøĘ·ŪÄ©£¬Ģ¼ĖįøĘÓėĖį·“Ӧɜ³É¶žŃõ»ÆĢ¼ĘųĢ壬Ķ¬ŹĒ“Ł½ųĢśĄė×ÓµÄĖ®½ā¶ų²śÉśĒāŃõ»ÆĢś³Įµķ£¬ĖłŅŌ³öĻÖµÄĻÖĻóĪŖĢ¼ĖįøĘÖš½„Čܽā£¬²śÉśĘųÅŻŗĶŗģŗÖÉ«³Įµķ£»
¹Ź“š°øĪŖ£ŗĢ¼ĖįøĘČܽā£¬²śÉśĘųÅŻŗĶŗģŗÖÉ«³Įµķ£®
µćĘĄ ±¾Ģāæ¼²é³żČ„ĀČ»ÆĶÖŠĀČ»ÆŃĒĢś²¢µĆµ½ĀČ»ÆĶ¾§ĢåµÄ·½·Ø£¬ÄŃ¶Č²»“ó£¬×¢Ņā³żŌÓ²»ÄÜŅżČėŠĀµÄŌÓÖŹ£¬Ń§ÉśÓ¦×¢Ņā·ÖĪö½ā¾öĪŹĢāŅŌ¼°Įé»īÓ¦ÓĆĖłŃ§ÖŖŹ¶µÄÄÜĮ¦£®


 53ĖęĢĆ²āĻµĮŠ“š°ø
53ĖęĢĆ²āĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1 L 0.1 mol/LµÄNaHSO3ČÜŅŗÖŠŗ¬HSO3-µÄŹżÄæĪŖ0.1NA | |
| B£® | ŅŃÖŖ2SO2£Øg£©+O2£Øg£©?2SO3£Øg£©”÷H=-196.6 kJ/mol£¬Ōņ½«1 mol SO2Óė×ćĮæO2»ģŗĻŗó³ä·Ö·“Ó¦·Å³öµÄČČĮæĪŖ98.3 kJ | |
| C£® | ¶čŠŌµē¼«µē½āĮņĖįĶµÄČÜŅŗ£¬µ±Ńō¼«Éś³É6.4 gĶŹ±£¬Ņõ¼«²śÉśµÄĘųĢåŌŚ±ź×¼×“æöĻĀĪŖ1.12 L | |
| D£® | ½šŹō·¢ÉśĪüŃõøÆŹ“Ź±£¬ĻūŗÄ1 mol O2£¬×ŖŅʵē×ÓŹżĪŖ4NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
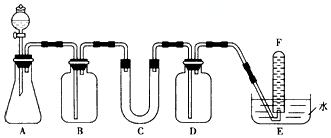
| ŅĒĘ÷ | ¼ÓČėŹŌ¼Į | ¼ÓČėŹŌ¼ĮµÄÄæµÄ |
| B | ±„ŗĶNaHCO3ČÜŅŗ | |
| D | ĪüŹÕ¹żĮæCO2 | |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 |  |  |  |
| Ķ¼¢ń¼īŠŌŠæĆĢµē³Ų | Ķ¼¢ņĒ¦Šīµē³Ų | Ķ¼¢óµē½ā¾«Į¶Ķ | Ķ¼¢ōŅųŠæŦæŪµē³Ų |
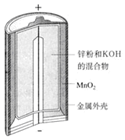
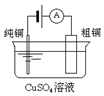
| A£® | Ķ¼¢ńĖłŹ¾µē³ŲÖŠ£¬ŠæĪŖøŗ¼«£¬MnO2µÄ×÷ÓĆŹĒ“߻ƼĮ | |
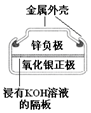
| B£® | Ķ¼IIĖłŹ¾µē³Ų¶žŃõ»ÆĒ¦ĪŖÕż¼«£¬·Åµē¹ż³ĢÖŠĮņĖįÅØ¶Č²»±ä | |
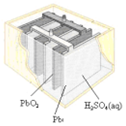
| C£® | Ķ¼IIIĖłŹ¾×°ÖĆ¹¤×÷¹ż³ĢÖŠ£¬µē½āÖŹČÜŅŗÖŠCu2+ÅØ¶ČŹ¼ÖÕ²»±ä | |
| D£® | Ķ¼IVĖłŹ¾µē³Ų¹¤×÷¹ż³ĢÖŠ£¬Ag2OŹĒŃõ»Æ¼Į |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  ׶ŠĪĘæ | B£® |  ŹŌ¹Ü | C£® |  ·ÖŅŗĀ©¶· | D£® |  ČŻĮæĘæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś¢Ü | B£® | ¢Ś¢Ü | C£® | ¢Ś¢Ū¢Ü | D£® | ¢Ł¢Ś¢Ū¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ČżŃõ»ÆĮņ | B£® | øɱł | C£® | ÕįĢĒČÜŅŗ | D£® | ĮņĖį±µ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
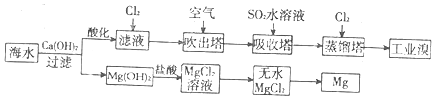
| A£® | ČōĢįČ”1 mol Br2£¬ÖĮÉŁŠčŅŖ±ź×¼×“æöĻĀ44.8 LµÄCl2 | |
| B£® | ¹¤ŅµÉĻ³£ĄūÓƵē½āČŪČŚMgCl2Ņ±Į¶½šŹōĆ¾ | |
| C£® | ø»¼ÆäåŌŖĖŲ¹ż³ĢÖŠ£¬æÕĘų“µ³ö·ØĄūÓĆĮĖäåŅ×»Ó·¢µÄŠŌÖŹ | |
| D£® | ¹¤ŅµäåÖŠŗ¬ÉŁĮæCl2£¬æÉÓĆĒāŃõ»ÆÄĘČÜŅŗ³żČ„ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĪļÖŹµÄĮæÅضČĪŖ0.5 mol/LµÄMgCl2ČÜŅŗÖŠ£¬ŗ¬ÓŠCl-µÄŹżÄæĪŖ NA | |
| B£® | 0.2 mol FeÓė×ćĮæĖ®ÕōĘų·“Ó¦£¬Éś³ÉµÄH2·Ö×ÓŹżÄæĪŖ0.3 NA | |
| C£® | ±ź×¼×“æöĻĀ£¬22.4LH2Oŗ¬ÓŠµÄ·Ö×ÓŹżĪŖNA | |
| D£® | Ņ»¶ØĢõ¼žĻĀ2.3gNaÓėŅ»¶ØĮæŃõĘų·“Ӧɜ³ÉNa2OŗĶNa2O2µÄ»ģŗĻĪļ£¬×ŖŅʵĵē×ÓŹżŅ»¶ØĪŖ0.1NA |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com