
 如图所示,若电解5min时铜电极质量增加2.16g,试回答:
如图所示,若电解5min时铜电极质量增加2.16g,试回答:| 2.16g |
| 108g/mol |
| 0.005mol |
| 0.2L |


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
| A、只含有Na+ |
| B、可能含Na+或K+的一种 |
| C、一定含有Na+和K+ |
| D、一定含Na+,也可能含K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl2溶液中通入Cl2 Fe2++Cl2═Fe3++2Cl- |
| B、Al2O3与NaOH溶液反应 Al2O3+2OH-═2AlO2-+H2O |
| C、FeCl3溶液与铜 Fe3++Cu═Fe2++Cu2+ |
| D、用醋酸除水垢 2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:
在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:
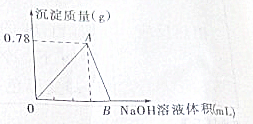 向20mL AlCl3溶液中滴入2mol?L-1 NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:
向20mL AlCl3溶液中滴入2mol?L-1 NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
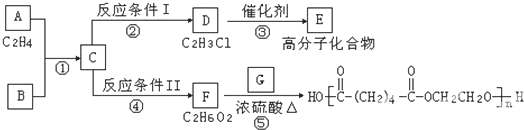
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com