
A、
| ||
B、
| ||
| C、16n | ||
| D、8n |
科目:高中化学 来源: 题型:
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| A、该反应的焓变为正值 |
| B、恒温恒容下,增大压强,H2浓度是定值,不改变 |
| C、升高温度,逆反应速率减小 |
| D、该反应化学方程式为CO+H2O?CO2+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸具有强氧化性,稀硫酸无氧化性 |
| B、浓硫酸不慎沾到皮肤上,立即用大量的水冲洗 |
| C、稀释浓硫酸时应将浓硫酸沿着烧杯壁慢慢地注入盛有水的烧杯中,并不断搅拌 |
| D、浓硫酸与铜的反应中,浓硫酸仅表现强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑥⑦⑨ | B、③⑤⑦⑨ |
| C、①④⑧⑩ | D、②⑥⑦⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B、生铁比软铁芯(几乎是纯铁)容易生锈 |
| C、铁质器件附有铜质配件,在接触处易生铁锈 |
| D、纯铝制品擦亮后,几天后表面又变暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
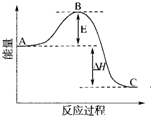 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:
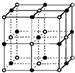 用序号填空:
用序号填空:| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com