
(12分)氮元素可形成氢化物、卤化物、氮化物、叠氮化物和配合物等多种化合物。
(1)肼(N2H4)可用作火箭燃料,其原理是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g),若反应中有4mol N-H 键断裂,则形成的π键有 mol。
(2)F2和过量NH3在铜催化作用下反应生成NF3,NF3分子的空间构型为 。
(3)铁和氨气在640℃发生置换反应,产物之一的晶胞见图1。该反应的化学方程式: 。
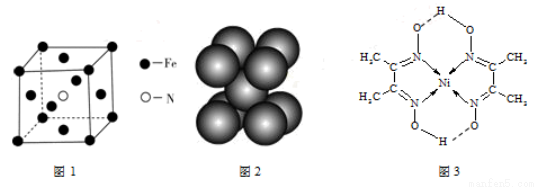
(4)叠氮化钠(NaN3)分解反应为:2NaN3(s)=2Na(l)+3N2(g),下列有关说法正确的是 。
a.常温下N2很稳定,是因为N的电负性大
b.钠晶胞见图2,每个晶胞含有2个钠原子
c.第一电离能(I1):N>O>S
d.NaN3与KN3结构类似,晶格能:NaN3<KN3
(5)配合物Y的结构见图3,Y中含有 (填序号);
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
Y中碳原子的杂化方式有 。
(1)3(2分) (2)三角锥形(2分)
(3)8Fe+2NH3  2Fe4N+3H2 (2分)(4)b c(2分,只选对1个给1分,选错不给分)
2Fe4N+3H2 (2分)(4)b c(2分,只选对1个给1分,选错不给分)
(5)a b c d (2分,只选1个不给分,选2或3个只给1分),sp2(1分) sp3(1分)
【解析】
试题分析:(1)肼(N2H4)可用作火箭燃料,其原理是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g),根据反应方程式可知若有8mol的N—H断裂,就会形成3mol的N2,其中含有6mol的π键,因此若反应中有4mol N-H键断裂,则形成的π键有3mol。(2)F2和过量NH3在铜催化作用下反应生成NF3,NF3分子的空间构型与NH3类似,为三角锥形;(3)铁和氨气在640℃发生置换反应,产物之一的晶胞见图1。根据晶胞结构可知,在该晶胞含有Fe:1/8×8+1/2×6=4,含有N原子个数是1,该物质的化学式是Fe4N,则根据质量守恒定律可得该反应的化学方程式是8Fe+2NH3  2Fe4N+3H2;(4)a.常温下N2很稳定,是因为原子半径小,两个N原子间共用三对电子,化学键的键能大,难断裂,错误;b.钠晶胞如图所示,则每个晶胞含有钠原子的个数是8×1/8+1=2,正确;c.一般情况下,元素的非金属性越强,其电离能就越大,但是当原子核外电子处于全充满、半充满或全空时是稳定的状态,失去电子较难,第一电离能就较大,元素元素的第一电离能大小是(I1):N>O>S ,正确; d.NaN3与KN3结构类似,属于离子晶体,由于离子半径K+>Na+,离子半径越大,离子结合形成的离子键的强度就越小,晶格能就越低,所以晶格能:NaN3>KN3,错误;(5)配合物Y的结构见图3,根据图示可知,在Y中含有:极性共价键、非极性共价键、配位键、氢键,因此选项是abcd。其中Y中碳原子的杂化方式有sp2杂化和sp3杂化。
2Fe4N+3H2;(4)a.常温下N2很稳定,是因为原子半径小,两个N原子间共用三对电子,化学键的键能大,难断裂,错误;b.钠晶胞如图所示,则每个晶胞含有钠原子的个数是8×1/8+1=2,正确;c.一般情况下,元素的非金属性越强,其电离能就越大,但是当原子核外电子处于全充满、半充满或全空时是稳定的状态,失去电子较难,第一电离能就较大,元素元素的第一电离能大小是(I1):N>O>S ,正确; d.NaN3与KN3结构类似,属于离子晶体,由于离子半径K+>Na+,离子半径越大,离子结合形成的离子键的强度就越小,晶格能就越低,所以晶格能:NaN3>KN3,错误;(5)配合物Y的结构见图3,根据图示可知,在Y中含有:极性共价键、非极性共价键、配位键、氢键,因此选项是abcd。其中Y中碳原子的杂化方式有sp2杂化和sp3杂化。
考点:考查原子的杂化、元素第一电离能的比较、物质的分子的空间构型、物质内含有的作用力的种类及数目的判断的知识。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源:2014-2015江苏省盐城市高二12月月考化学试卷(解析版) 题型:选择题
11.室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是

A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B.b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C.c点:c(Cl-)=c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省广安市高三“一诊”理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.将0.1 molFeCL3溶液于1 L水中,所得溶液含Fe3+离子数目为0.1 NA
B.1 mol的羟基与1 mol的氢氧根离子所含电子数均为10NA
C.常温、常压下,4.6 g NO2和N2O4混合气体中含有的氧原子数目为0.2NA
D.在高温下,有1 mol Fe与足量的水蒸气反应,转移电子的数目为3NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期期末理综化学试卷(解析版) 题型:填空题
【物质结构与性质】(15分)钙的化合物在工农业生产和生活中有广泛的应用.
(1)已知CaC2与水反应生成乙炔.请回答下列问题:
①将乙炔通入[Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀,Cu+基态核外电子排布式为___________________.
②CaC2中C22-与O22+互为等电子体,1molO22+中含有的π键数目为_________.
③乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子轨道杂化类型是_______________,构成丙烯腈元素中第一电离能最大的是__________.
(2)抗坏血酸钙的组成为Ca(C6H7O6)2?4H2O,其结构示意图如图1:

该物质中存在的化学键类型包括____________(填字母).
A.金属键 B.离子键 C.非极性共价键 D.配位键
(3)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图2所示:由此可判断该钙的氧化物的化学式为____________.已知阿伏加德罗常数为NA,该晶体的密度为ρg·cm3,则晶胞中两Ca2+间的最近距离为______________cm.(用含NA、ρ的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期期末理综化学试卷(解析版) 题型:选择题
如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g.。

下列说法正确的是
A.Na2O2晶体中阴阳离子数目之比为1∶1
B.反应③最多能产生0.05 mol O2
C.反应①的离子方程式为Na+2H2O==Na++2OH-+H2↑
D.①、②、③充分反应后所得溶液的质量分数从大到小的顺序为①>②>③
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:填空题
(12分)钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。
(1)酸浸时发生的反应的离子方程式为 ;为提高BaCO3的酸浸率,可采取的措施为 (任答一点)。
(2)配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,目的是 。
(3)加入H2C2O4溶液时,发生反应的化学方程式为 ;
可循环使用的物质X是 。
(4)煅烧得到BaTiO3的同时,生成高温下的气体产物有CO、 和 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:选择题
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价绝对值相等,Z的核电荷数是Y的2倍,W最外层电子数是最内层电子数的3倍.下列说法正确的是
A.微粒半径:Z2+>W2->R-
B.对应氢化物的稳定性:W>R
C.W与X、W与Z形成的化合物晶体类型相同
D.Y的最高价氧化物对应的水化物是弱酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:选择题
一定温度下,在三个体积均为1.0L的恒容密闭容器中,充入一定量的H2和SO2发生下列反应:
3H2(g)+SO2(g)  2H2O(g)+H2S(g)
2H2O(g)+H2S(g)
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
H2 | SO2 | H2 | SO2 | ||
容器I | 300 | 0.3 | 0.1 | / | 0.02 |
容器II | 300 | 0.6 | 0.2 | / | / |
容器III | 240 | 0.3 | 0.1 | / | 0.01 |
下列说法正确的是
A.该反应正反应为吸热反应
B.容器II达到平衡时SO2的转化率比容器I小
C.容器III达到平衡的时间比容器I短
D.240℃时,该反应的平衡常数为1.08×104L? mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏常州市高三第一次调研试卷化学试卷(解析版) 题型:实验题
(12分)某兴趣小组的同学发现,将CuSO4溶液与Na2CO3溶液混合会产生蓝绿色沉淀。他们对沉淀的组成很感兴趣,决定采用实验的方法进行探究。
【提出猜想】
猜想1:所得沉淀为 ;
猜想2:所得沉淀为 ;
猜想3:所得沉淀为碱式碳酸铜[化学式可表示为mCu (OH)2·nCuCO3]。
查阅资料获知,无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【实验探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干。
步骤2:取一定量所得固体,用如下装置(夹持仪器未画出)进行定性实验。
能证明猜想1成立的实验现象是 。
【问题讨论】
(1)检查上述虚线框内装置气密性的实验操作是:关闭K, 。
(2)若在上述装置B中盛放无水CaCl2,C中盛放Ba(OH)2溶液,还可测定所得沉淀的组成。
①C中盛放Ba(OH)2溶液,而不使用澄清石灰水的原因是 。
②若所取蓝绿色固体质量为27.1 g,实验结束后,装置B的质量增加2.7 g,C中产生沉淀的质量为19.7 g。则该蓝绿色固体的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com