
| 0.1Vb-0.01Va |
| Vb+Va |


科目:高中化学 来源: 题型:
| A、用淀粉与KI溶液作用检验淀粉 |
| B、将铁屑、溴水、苯混合制溴苯 |
| C、用胆矾去检验酒精中是否含水 |
| D、将铜丝在酒精灯加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
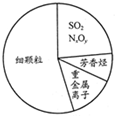
| A、大量燃烧化石燃料是造成雾霾天气的一种重要因素 |
| B、重金属离子可导致蛋白质变性 |
| C、SO2和NxOy均属于酸性氧化物 |
| D、苯是最简单的芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在80℃pH=10的溶液中:Na+、CH3CHO、Ag(NH3)2+、NO3- | ||
| B、溶液中能大量共存,通入CO2后仍能大量共存:K+、Ca2+、Cl-、NO3- | ||
| C、与镁反应只产生氢气的溶液中:NO3-、Cl-、H+、A13+ | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B、在稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ |
| C、在101kPa时,2g的氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol |
| D、由C(s,石墨)=C(s,金刚石)△H=+1.90kJ/mol可知,石墨比金刚石稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 通电 |
| A、电池工作时,锌失去电子 |
| B、电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq) |
| C、电池工作时,电子由正极通过外电路流向负极 |
| D、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com