
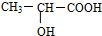 ,回答下列问题:
,回答下列问题: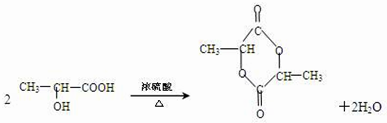
 .
. 分析 (1)A中官能团名称是醇羟基和羧基;该物质分子式为C3H6O3,可以写为C3(H2O)3,所以该物质燃烧时只有C需要氧气,1molA完全燃烧需要3mol氧气,与A以任意比混合,若只要总物质的量不变,说明给予选项中1mol燃烧是也需要3mol氧气;
(2)A中含有羧基,能发生酯化反应;
(3)A含有羧基和醇羟基,所以能发生缩聚反应生成高分子化合物;
(4)在一定条件下,A能反应生成B,B能使溴的四氯化碳溶液褪色,则A发生消去反应生成B,B为CH2=CHCOOH,B还能反应生成高分子化合物C,C为聚丙烯酸.
解答 解:(1)A中官能团名称是醇羟基和羧基;该物质分子式为C3H6O3,可以写为C3(H2O)3,所以该物质燃烧时只有C需要氧气,1molA完全燃烧需要3mol氧气,与A以任意比混合,若只要总物质的量不变,说明给予选项中1mol燃烧是也需要3mol氧气,
A、C2H6O可以写为C2H4(H2O),1mol该物质完全燃烧需要3mol氧气,符合条件,故A正确;
B、C3H4O2可以改写为C3(H2O)2,1mol该物质完全燃烧需要3mol氧气,符合条件,故B正确;
C、1molC2H4完全燃烧需要3mol氧气,符合条件,故C正确;
D、1molC3H6完全燃烧需要4.5mol氧气,不符合条件,故D错误;
故答案为:醇羟基、羧基;ABC;
(2)A中含有羧基,能发生酯化反应,反应方程式为 ,故答案为:
,故答案为: ;
;
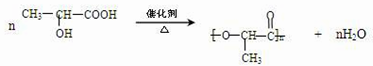
(3)A含有羧基和醇羟基,所以能发生缩聚反应生成高分子化合物,反应方程式为 ,
,
故答案为: ;
;
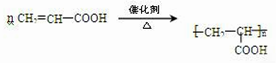
(4)在一定条件下,A能反应生成B,B能使溴的四氯化碳溶液褪色,则A发生消去反应生成B,B为CH2=CHCOOH,B还能反应生成高分子化合物C,C为聚丙烯酸,B生成C的方程式为 ,
,
故答案为: .
.
点评 本题考查有机物推断及有机物结构和性质,为高频考点,侧重考查学生分析推断能力,明确官能团及其性质关系是解本题关键,注意反应中断键和成键方式,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 第ⅢB族元素种类最多 | |
| B. | 只有第3列到第12列全部是金属元素 | |
| C. | 周期数大于或等于族的序数时,一定是金属元素 | |
| D. | 是按原子的质量数由小到大的顺序编制的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,加水稀释后,n(H+)•n(OH-)的乘积不变 | |
| B. | 离子浓度关系:3c(Fe3+)+c(NH4+)+c(H+)=c(OH-)+2c(SO42-) | |
| C. | 溶液呈酸性是因为NH4++H2O?NH3H2O+H+ | |
| D. | 温度升高(假设溶液的体积没有变化)溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25mol/L | B. | 0.44mol/L | C. | 0.5mol/L | D. | 0.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | N原子的第一电离能大于O原子 | N原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C=O之间的夹角为120° |
| C | H2O的沸点大于H2S的沸点 | H2O是液态的,H2S是气态的 |
| D | HF比HCl稳定 | HF分子间可以形成氢键 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
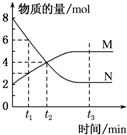 一定温度下,某容积为2L的密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
一定温度下,某容积为2L的密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
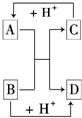 已知A、B、C、D是中学化学中常见的四种不同粒子.它们之间存在如图所示的转化关系.
已知A、B、C、D是中学化学中常见的四种不同粒子.它们之间存在如图所示的转化关系.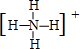 ,D的电子式
,D的电子式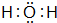 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有离子键,可能含共价键,共价化合物中只含共价键绝不含有离子键 | |
| B. | 单质分子中均存在化学键,且只含有共价键,不可能含有离子键 | |
| C. | 共价化合物中可能含非极性共价键,离子化物中不可能含非极性共价键 | |
| D. | 共价化合物中可能含离子键,离子化合物中只含离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com