
| A. | 能够使甲基橙呈现黄色 | B. | 溶液的pH>7 | ||
| C. | 溶液中:c(H+)>1×10-7mol•L-1 | D. | 溶液中:c(H+)<c(OH-) |
分析 水溶液中都含有氢离子和氢氧根离子,溶液酸碱性取决于氢离子和氢氧根离子的浓度的相对大小:[H+]>[OH-]溶液呈酸性;[H+]=[OH-]溶液呈中性;[H+]<[OH-]溶液呈碱性;水的电离是吸热过程,改变温度后水的离子积发生变化,则不能直接根据溶液pH大小判断溶液酸碱性,据此进行解答.
解答 解:A.甲基橙变色范围为:3.1(红)-4.4(黄),能使甲基橙呈现黄色的溶液可能为酸性,不一定显碱性,故A错误;
B.没指明温度,Kw不一定等于10-14,温度不同溶液中离子积不同,不能根据pH大小判断溶液的酸碱性,故B错误;
C.常温下水的离子积Kw=10-14,若c(H+)>1×10-7mol•L-1,则c(OH-)<10-7,则溶液为酸性,故C错误;
D.溶液显酸性、中性还是碱性,取决于溶液中c(H+)和c(OH-)的相对大小,若c(H+)<c(OH-),说明溶液一定呈碱性,故D正确;
故选D.
点评 本题考查溶液酸碱性的判断方法,题目难度不大,明确溶液酸碱性与氢离子、氢氧根离子浓度的关系为解答关键,注意温度对水的电离的影响情况,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$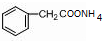 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解、过滤、蒸发 | B. | 溶解、过滤、洗涤、干燥 | ||
| C. | 溶解、过滤、结晶 | D. | 溶解、结晶、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除⑤外 | B. | 仅④⑤ | C. | 仅①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
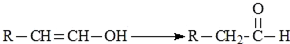
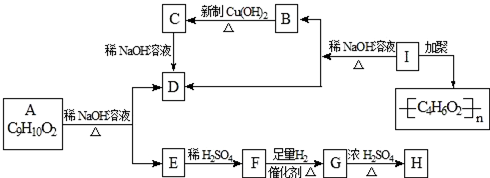
 ,H:CH3COOCH=CH2.
,H:CH3COOCH=CH2.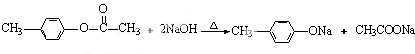 +H2O.
+H2O. ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 石墨燃烧热为-393.5kJ/mol | |
| B. | CO2和金刚石(或石墨)反应生成CO为吸热反应 | |
| C. | 等量金刚石和石墨完全燃烧,石墨放出的热量更多 | |
| D. | 12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252.0kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与稀盐酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 盐酸与NaOH溶液反应:H++OH-═H2O | |
| C. | CaCO3与稀HNO3反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | BaCl2溶液与Na2SO4溶液反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com