
序号 | 时间/min 物质的量/mol 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
分析 (1)实验1和实验2比较,温度、起始物质的量均相同,实验2达到平衡的时间少;
(2)结合v=$\frac{△c}{△t}$计算HI的反应速率,再结合速率之比等于化学计量数之比计算H2的平均反应速率;
(3)由表格数据可知,HI起始的物质的量为1.0mol,平衡时的物质的量为0.2mol,以此计算.
解答 解:(1)实验1和实验2比较,温度、起始物质的量均相同,实验2达到平衡的时间少,则实验2中使用了催化剂,故答案为:2;
(2)v(HI)=$\frac{△c}{△t}$=$\frac{\frac{1mol-0.8mol}{2L}}{10min}$=0.01mol/(L.min),由速率之比等于化学计量数之比可知H2的平均反应速率为0.01mol/(L.min)×$\frac{1}{2}$=0.005mol/(L.min),
故答案为:0.005;
(3)由表格数据可知,HI起始的物质的量为1.0mol,平衡时的物质的量为0.2mol,则HI(g)转化率为$\frac{1.0mol-0.2mol}{1.0mol}$×100%=80%,故答案为:80%.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据、平衡时物质的量、速率及转化率计算等为解答的关键,侧重分析与计算能力的考查,注意表格数据的分析与应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 电石气的结构式H-C≡C-H
电石气的结构式H-C≡C-H .
. .
.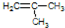 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁是人体健康、植树生长所必须的元素之一,缺铁时可用补充FeSO4的方法补铁 | |
| B. | 在采煤作业中,把炸药和干冰放在一起,既能增强爆炸威力,又能防止火灾 | |
| C. | 氢氧燃料电池已用于航天飞机,燃料电池的能量转化率理论上可达100% | |
| D. | 聚乙烯塑料可用于制作餐具 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
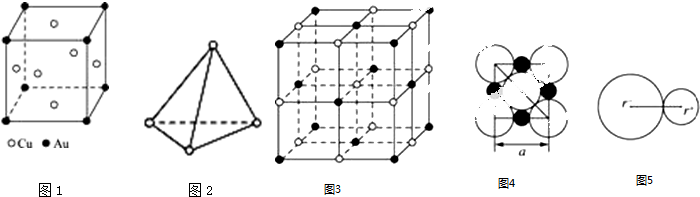
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g N2和32g O2 | B. | 34g NH3 和4g H2 | ||
| C. | 2LCO2和2LH2O | D. | 11.2LO2和0.5molO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com