
【题目】某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应:
实验:向盛有2mL 0.1mol/L Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色.
探究1:白色沉淀产生的原因.
(1)白色沉淀是 .
(2)分析白色沉淀产生的原因,甲同学认为是NO3﹣氧化了SO2 , 乙同学认为是溶液中溶解的O2氧化了SO2 .
①支持甲同学观点的实验证据是 .
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式 .
(3)乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
实验操作 | 实验现象 |
向2mLmol/L溶液(填化学式)中通入SO2 |
(4)探究2:在氧化SO2的过程中,NO3﹣和O2哪种微粒起到了主要作用.
实验操作 | 实验数据 |
向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 |
|
向烧杯中分别加入25mL 0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2 , 用pH传感器分别测定溶液pH随时间(t)变化的曲线. |
|
图1,在无氧条件下,BaCl2溶液pH下降的原因是 .
(5)图2,BaCl2溶液中发生反应的离子方程式为 .
(6)依据上述图象你得出的结论是 , 说明理由 .
【答案】
(1)BaSO4
(2)液面上方略显浅棕色;3Ba2++2NO3﹣+3SO2+2H2O=3BaSO4↓+2NO+4H+
(3)0.1;BaCl2;试管内有白色沉淀产生
(4)SO2+H2O?H2SO3 , H2SO3?HSO3﹣+H+
(5)2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+
(6)在氧化SO2的过程中,O2起了主要作用;在BaCl2溶液中起氧化作用的是O2 , 在Ba(NO3)2溶液中起氧化作用的是O2和NO3﹣ , 而图2中,分别向BaCl2、Ba(NO3)2溶液中通入SO2 , pH变化趋势、幅度接近,因此起氧化作用的主要是O2
【解析】解:(1.)SO2与Ba(NO3)2溶液的反应,根据元素守恒可知,白色沉淀应为BaSO4 , 所以答案是:BaSO4;
(2.)①NO3﹣氧化了SO2 , 则硝酸根被还原成一氧化氮,一氧化氮可以再被氧化成二氧化氮,使得液面上方略显浅棕色,所以支持甲同学观点的实验证据是液面上方略显浅棕色,所以答案是:液面上方略显浅棕色;②Ba(NO3)2溶液与SO2反应生成硫酸钡和一氧化氮,反应的离子方程式为3Ba2++2NO3﹣+3SO2+2H2O=3BaSO4↓+2NO+4H+ , 所以答案是:3Ba2++2NO3﹣+3SO2+2H2O=3BaSO4↓+2NO+4H+;
(3.)乙同学要证明了自己的推测正确,所用试剂应与甲同学一样,这样才可以做对比,所以所用试剂为0.1mol/LBaCl2溶液,可以看到有白色沉淀出现,所以答案是:0.1;BaCl2;试管内有白色沉淀产生;
(4.)在无氧条件下,二氧化硫溶于水生成亚硫酸,亚硫酸会使溶pH值下降,反应的方程式为SO2+H2OH2SO3 , H2SO3HSO3﹣+H+ , 所以答案是:SO2+H2OH2SO3 , H2SO3HSO3﹣+H+;
(5.)图2,BaCl2溶液中通入二氧化硫,与图1相比酸性明显增加,说明氧气参加了反应,生成了硫酸钡和盐酸,反应的离子方程式为2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+ , 所以答案是:2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+;
(6.)比较图1和图2可知,在氧化SO2的过程中,O2起了主要作用,因为在BaCl2溶液中起氧化作用的是O2 , 在Ba(NO3)2溶液中起氧化作用的是O2和NO3﹣ , 而图2中,分别向BaCl2、Ba(NO3)2溶液中通入SO2 , pH变化趋势、幅度接近,所以答案是:在氧化SO2的过程中,O2起了主要作用;在BaCl2溶液中起氧化作用的是O2 , 在Ba(NO3)2溶液中起氧化作用的是O2和NO3﹣ , 而图2中,分别向BaCl2、Ba(NO3)2溶液中通入SO2 , pH变化趋势、幅度接近,因此起氧化作用的主要是O2 .


科目:高中化学 来源: 题型:
【题目】下列有关实验操作的说法中,错误的是( )
A. 振荡试管中的液体时,应用手指拿住试管,左右摆动手腕振荡试管
B. 在做蒸馏实验时要加入少量的碎瓷片,以防止溶液暴沸
C. 如果皮肤上不慎沾上浓硫酸,应立即用大量的NaOH稀溶液冲洗
D. 用石蕊或酚酞试纸进行气体验满时,先用蒸馏水湿润试纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是
A. NH![]() 、SO
、SO![]() 、CO
、CO![]() 、K+ B. Na+、Ba2+、Ca2+、HCO
、K+ B. Na+、Ba2+、Ca2+、HCO![]()
C. Mg2+、SO![]() 、K+、Cl- D. K+、Cl-、Na+、SO
、K+、Cl- D. K+、Cl-、Na+、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
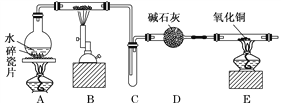
(1)A装置的作用是________________,B中反应的化学方程式为_____________。
(2)D的作用是____________________________________________________________。
(3)E中的现象是__________________________________________________________。
(4)A、B两个装置中应先点燃_______处的酒精灯,点燃E处酒精灯之前应进行的操作是_______________________________________________________________________。
【答案】 产生水蒸气 3Fe+4H2O(g) ![]() Fe3O4+4H2 吸收未反应的水蒸气 黑色固体变为红色,右端管壁有水珠生成 A 收集H2,并检验其纯度
Fe3O4+4H2 吸收未反应的水蒸气 黑色固体变为红色,右端管壁有水珠生成 A 收集H2,并检验其纯度
【解析】(1)铁与水蒸气反应的条件是高温,水的状态是气体,所以A装置的作用是产生水蒸气,B中是铁与水蒸气反应生成氢气和四氧化三铁,方程式为3Fe+4H2O(g)![]() Fe3O4+4H2;(2)生成的氢气中含有水蒸气,则D中碱石灰的作用是吸收未反应的水蒸气;(3)氢气还原氧化铜得到铜和水即H2+CuO
Fe3O4+4H2;(2)生成的氢气中含有水蒸气,则D中碱石灰的作用是吸收未反应的水蒸气;(3)氢气还原氧化铜得到铜和水即H2+CuO![]() Cu+H2O,所以实验现象是硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成;(4)若先点燃B处,铁会与氧气先发生反应,所以须先点燃A处;氢气是可燃性气体混有空气会发生爆炸,所以点燃E处酒精灯之前应进行的操作是验证氢气的纯度。
Cu+H2O,所以实验现象是硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成;(4)若先点燃B处,铁会与氧气先发生反应,所以须先点燃A处;氢气是可燃性气体混有空气会发生爆炸,所以点燃E处酒精灯之前应进行的操作是验证氢气的纯度。
【题型】实验题
【结束】
20
【题目】某研究性学习小组为研究氯气是否具有漂白性,设计如图所示实验装置。试根据实验装置回答下列问题:
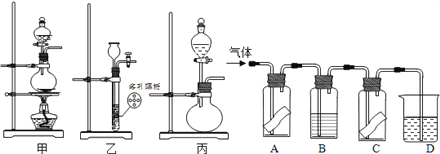
A、C中为干燥的有色布条,B为无色液体,D中为NaOH溶液。
(1)在常温下,KMnO4固体可以与浓盐酸反应生成氯气,其反应方程式为2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,则其反应装置应选用甲、乙、丙中的_______。
(2)B中的液体为____________,其作用为____________________________________。
(3)A、C中有色布条的颜色变化分别为__________________________________,A、C的实验现象说明氯气是否具有漂白性?________(填“是”或“否”)。
(4)D中NaOH溶液的作用是________________________________________(用离子方程式说明)。
(5)将产生的氯气通入滴有酚酞的NaOH溶液中,溶液红色褪去。小组内有甲、乙两种意见:
甲:氯气溶于水后溶液显酸性,中和了NaOH,使溶液褪为无色;
乙:氯气溶于水生成漂白性物质,使溶液褪为无色。
丙同学在褪色后的溶液中逐渐加入足量的NaOH溶液,溶液一直未见红色,则______(填“甲”或“乙”)的意见正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O == Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液:Al+2OH-== AlO![]() +H2↑
+H2↑
C.金属铝溶于盐酸中:2Al+6H+ == 2Al3++3H2↑
D.铁跟稀硫酸反应:Fe+2H+ == Fe3++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为应用广泛的金属单质、B溶液呈浅绿色、C溶液焰色反应呈紫色、C溶液可使酚酞溶液呈红色,各物质有如图所示的相互转化:

试回答:
(1)写出B的化学式_________________,D的化学式_________________。
(2)写出由E转变成F的化学方程式__________________________________。
(3)写出向G溶液中加入A的离子方程式:____________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于各图的说法(其中①③④中均为惰性电极)正确的是( )
A.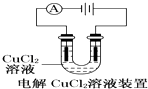
装置中阴极产生的气体能够使湿润淀粉KI试纸变蓝
B.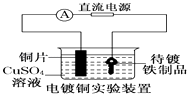
装置中待镀铁制品应与电源正极相连
C.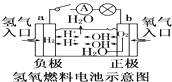
装置中电子由b极流向a极
D.
装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com