
| A、原子半径:W>Z>Y>X |
| B、Z元素在周期表的位置为第三周期第ⅡA族 |
| C、丁的稳定性小于甲烷 |
| D、丙的水溶液呈碱性 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、2.4g | B、3.36g |
| C、5.60g | D、6.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X |
| B、化合物X2W2、YW2、ZW、ZW2等都含有极性共价键,但都属于非极性分子 |
| C、用M单质作阳极,石墨电极作阴极电解NaHCO3溶液,电解一段时后,在阴极区会出现白色沉淀 |
| D、X、Z两元素能形成原子个数比(X:Z)为3:1和4:2的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、臭氧是饮用水的理想消毒剂之一,因为它杀菌能力强且不影响水质 |
| B、因患“禽流感”而被捕杀的家禽尸体常用生石灰处理 |
| C、医疗上常用体积分数为75%的酒精进行皮肤消毒 |
| D、食品加工、消毒、防腐常使用福尔马林 |
查看答案和解析>>
科目:高中化学 来源: 题型:
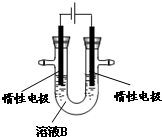 据报道,有一种叫Thibacillus Ferroxidans 的细菌在氧气存在下的酸性溶液中,能将黄铜矿(CuFeS2)氧化成硫酸盐,发生的反应为:
据报道,有一种叫Thibacillus Ferroxidans 的细菌在氧气存在下的酸性溶液中,能将黄铜矿(CuFeS2)氧化成硫酸盐,发生的反应为:| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L一氯甲烷和二氯甲烷的混合物所含氯原子数介于NA至2NA之间 |
| B、1mol的Cu在一定条件下与足量硫粉反应,转移电子数目为2NA |
| C、3.65g液态氯化氢中分子的数目为0.1NA |
| D、常温下5.6g铁投入到足量的浓硝酸中,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
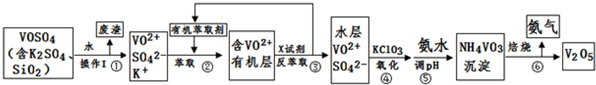
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com