
| A. | 水比硫化氢气体稳定 | B. | 水的熔沸点比硫化氢高 | ||
| C. | 氯化氢气体易溶于水 | D. | 过氧化氢易分解 |
分析 A.稳定性与化学键有关,与氢键无关;
B.水分子之间能形成氢键,熔沸点较高;
C.HCl是极性分子,易溶于极性溶剂水;
D.稳定性与化学键有关,与氢键无关.
解答 解:A.水比硫化氢气体稳定,是因H-O键能比H-S键能大,而与氢键无关,故A不选;
B.水分子之间能形成氢键,熔沸点较高,硫化氢分子之间只有分子间作用力,所以水的熔沸点比硫化氢高,故B选;
C.HCl是极性分子,易溶于极性溶剂水,HCl与水分子之间不能形成氢键,故C不选;
D.过氧化氢易分解,是因为过氧化氢中共价键不稳定,与氢键无关,故D不选;
故选:B.
点评 本题考查了氢键对物质的性质的影响,明确氢键主要影响物质的物理性质是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 实验室中灼烧操作通常在坩埚中进行 | |
| B. | 若X为烧碱,则Z为氨气,沉淀a为红棕色,可作颜料 | |
| C. | 若X为盐酸,则Z为CO2,溶液丙只含NaCl和Na2CO3 | |
| D. | 上述过程中所发生的反应有分解反应、复分解反应、氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需要的时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④⑥ | C. | ②③⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| W | 氮 | Y | |
| X | 硫 | Z |
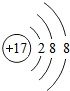 ;写出工业生产X单质粗产品的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO.
;写出工业生产X单质粗产品的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com