
下列说法正确的是:
A、标准状况下,33.6 L SO3中含有的氧原子数是4.5NA
B、1 mol OH-和1 mol—OH(羟基)中含有的电子数均为9NA
C、在加热条件下,100 mL18.4 mol/L的浓硫酸与足量金属铜反应得到的SO2的分子数为0.92 NA
D、当0.2 mol Na218O2与足量CO2完全反应后,生成碳酸钠的质量为21.6 g
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:填空题
【化学——选修2:化学与技术】(15分)
技术的发展与创新永无止境,我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如图

(1)向沉淀池中要通入CO2和氨气,应选通入______(填化学式)。原因是______________。
(2)沉淀池中发生反应的化学方程式是__________________________________。
(3)母液中的溶质主要是________。向母液中通氨气加入细小食盐颗粒,冷却析出副产品,通入氨气的作用是_____________________________________________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环,物质X是__________,从沉淀池中提取沉淀的操作是__________。
(5)写出煅烧炉中发生反应的化学方程式_____________________________。
(6)这样制得的产品碳酸钠中可能含有的杂质是____________(填化学式),为检验该杂 质的存在,具体操作是__________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期第二次模考试化学试卷(解析版) 题型:选择题
用下列装置不能达到有关实验目的的是

A.用甲图装置证明ρ(煤油)<ρ(钠)<ρ(水)
B.用乙图装置制备Fe(OH)2
C.用丙图装置制取金属锰
D.用丁图装置比较NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:选择题
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42—、CO32—等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是

A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B.原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1
C.原溶液中一定含有SO42—和Na+
D.反应最后形成的溶液中溶质只有Na2SO4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:选择题
下列比较不正确的是
A.等浓度的NH4HSO4、 NH3·H2O、 (NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的五种溶液,其中(NH4)2Fe(SO4)2溶液中c(NH4+)最大
B.NaClO和BaCl2混合溶液: c(Na+)+2c(Ba2+)=c(ClO-)+c(HClO)+c(Cl-)
C.25 ℃下,0.2 mol·L-1 HCl溶液与0.2 mol·L-1 YOH(一元弱碱)溶液等体积混合(忽略混合后溶液体积的变化),则c(Cl-)=c(Y+)+c(YOH)=0.2 mol·L-1
D.常温下,将0.2 mol·L-1某一元碱ROH溶液和0.1 mol·L-1HCl溶液等体积混 合,混合后溶液pH<7,则c(ROH)>c(R+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.需要加热的化学反应都是吸热反应
B.水力发电是将化学能转化为电能的过程
C.某吸热反应能自发进行,因此该反应是熵增反应
D.原电池是将电能转化为化学能的一种装置
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省赣州市十二县高三上学期期中化学试卷(解析版) 题型:选择题
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,
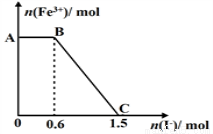
下列说法中不正确的是
A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I- =2Fe2++I2
C.开始加入的K2Cr2O7为0.25 mol
D.K2Cr2O7可与FeSO4反应的物质的量为1:3。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三上学期期中化学试卷(解析版) 题型:填空题
(14分)氢能以其洁净、高效、高热值、环境友好等特点成为最有前途的新能源,制氢和储氢的方法有很多。
(1)下图所示电化学装置工作时均与H2有关。

①图A所示装置可用于电解K2MnO4制KMnO4,通电一段时间后阴极附近溶液的pH将会 (填“增大”、“减小”或“不变”) 。
②图B所示装置为吸附了氢气的纳米碳管等材料制作的二次电池的原理,
开关连接用电器时,镍电极发生 (填“氧化”或“还原”)反应;开关连接充电器时,阳极的电极反应为 。
(2)热化学循环法制氢。已知:
①2Br2(g)+2CaO(s) == 2CaBr2(s)+O2(g) △H= —146kJ·mol—1
②3FeBr2(s)+4H2O(g) == Fe3O4(s)+6HBr(g)+H2(g) △H= +384kJ·mol—1
③CaBr2(s)+H2O(g) == CaO(s)+2HBr(g) △H= +212kJ·mol—1
④Fe3O4(s)+8HBr(g) == Br2(g)+3FeBr2(s)+4H2O(g) △H= —274kJ·mol—1
则2H2O(g) == 2H2(g)+O2(g)的△H= kJ·mol—1。
(3)光电化学分解制氢,原理如图所示,钛酸锶光电极的电极反应为4OH–– 4e–===O2+2H2O,则铂电极的电极反应为 。

(4)生物质制氢,若将生物质气化炉中出来的气体[主要有CH4、CO2、H2O(g)、CO及H2]在1.01×105Pa下进入转换炉,改变温度条件,各成分的体积组成关系如下图所示。下列有关图像的解读正确的是 。

A.利用CH4与H2O(g)及CO2转化为合成气CO和H2理论上是可行的
B.CH4(g)+CO2(g)→2CO(g)+2H2(g)和CH4(g)+H2O(g) → CO(g)+3H2(g),都是放热反应
C.CH4与CO2及H2O(g)转化为合成气CO和H2的适宜温度约为900℃
D.图像中曲线的交点处表示反应达到平衡
(5)LiBH4具有非常高的储氢能力,分解时生成氢化锂和两种单质,试写出该分解反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列溶液中Cl-的物质的量浓度最大的是
| A.200 mL 2 mol·L-1 MgCl2溶液 |
| B.1000 mL 2.5mol·L-1NaCl溶液 |
| C.250 mL 1 mol·L-1 AlCl3溶液 |
| D.300 mL 5 mol·L-1 KClO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com