
| 元素 | E1 | E2 | E3 | E4 |
| X | 522.05 | 7324.8 | 11856.6 | … |
| Y | 898.8 | 1763.58 | 14901.6 | 21084 |
| Z | 803.46 | 2436 | 3672.9 | 25116 |
| A. | X的原子电子层结构为1s22s1 | B. | Y为ⅡA族元素,其元素符号为Mg | ||
| C. | Z的价电子数为1 | D. | X的原子半径小于Y的原子半径 |
分析 根据同周期元素的电离能判断元素的种类,X的E2电离能突然增大,说明最外层有1个电子,应为Li,Y的E3电离能突然增大,说明最外层有2个电子,应为Be,Z的E4电离能突然增大,说明最外层有3个电子,应为B元素,根据元素的性质解答.
解答 解:原子序数相连的X、Y、Z三种元素,均位于第二周期,X的E2电离能突然增大,说明最外层有1个电子,应为Li元素,Y的E3电离能突然增大,说明最外层有2个电子,应为Be元素,Z的E4电离能突然增大,说明最外层有3个电子,应为B元素,
A.X为Li元素,原子电子层结构为1s22s1,故A正确;
B.Y为Be元素,在周期表中位于第二周期第IIA族,故B错误;
C.由分析可知,Z为B元素,其价电子数为3,故C错误;
D.同周期从左到右原子半径逐渐减小,则X的原子半径大于Y的原子半径,故D错误.
故选A.
点评 本题考查元素电离能的有关知识,题目难度不大,本题注意根据电离能的变化判断元素核外电子排布为解答该题的关键,注意把握元素周期律的递变规律.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题

| A. | 该分子中存在肽键 | |
| B. | 最多可以有12个碳原子共平面 | |
| C. | 1 mol氯雷他定最多可与8 mol氢气发生加成反应 | |
| D. | 能与NaOH溶液反应,但不能与NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
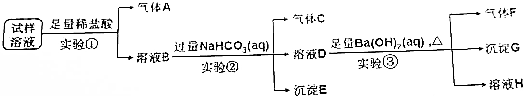
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
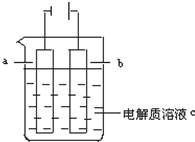 如图所示:
如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
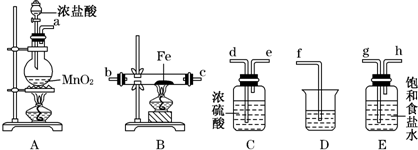
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24L H2O中含有极性共价键的数目为0.2NA | |
| B. | 0.1mol•L-1 NH4Cl溶液中含有NH4+的数目小于0.1NA | |
| C. | 100mL 12mol•L-1的浓HNO3与过量Cu反应转移电子的数目为0.6NA | |
| D. | 标准状况下,11.2L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②⑤ | C. | ③⑤ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com