
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)FeO(s)+CO(g) ΔH>0,1 100 ℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示。
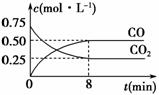
(1)该反应的平衡常数表达式K=________。
(2)下列措施中能使平衡常数K增大的是________(填序号)
A.升高温度 B.增大压强
C.充入一定量CO D.降低温度
(3)8 min内,CO的平均反应速率v(CO)=________mol·L-1·min-1。
(4)1 100 ℃时,2 L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 3 mol Fe、2 mol CO2 | 4 mol FeO、3 mol CO |
| CO的浓度(mol·L-1) | c1 | c2 |
| CO2的体积分数 | φ1 | φ2 |
| 体系压强(Pa) | p1 | p2 |
| 气态反应物的转化率 | α1 | α2 |
①下列说法正确的是________。
A.2c1=3c2 B.φ1=φ2
C.p1<p2 D.α1=α2
②求c1=________、φ1=________、α2=________。
解析 (1)平衡常数表达式中不能出现固体物质的浓度,则K= =
=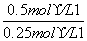 =2。(2)平衡常数只受温度的影响,由于该反应为吸热反应,所以升温,能增大平衡常数。(3)求平均反应速率时,应用浓度的变化值除以时间,即v(CO)=
=2。(2)平衡常数只受温度的影响,由于该反应为吸热反应,所以升温,能增大平衡常数。(3)求平均反应速率时,应用浓度的变化值除以时间,即v(CO)=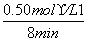 =0.062 5 mol·L-1·min-1。(4)由图像可计算平衡常数,K=
=0.062 5 mol·L-1·min-1。(4)由图像可计算平衡常数,K= =
=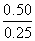 =2。①A项,温度相同,则甲、乙两容器中反应的平衡常数相同,即
=2。①A项,温度相同,则甲、乙两容器中反应的平衡常数相同,即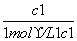 =
=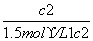 ,由此可得,c1<c2,3c1=2c2,错误;B项,由于该反应为等体积反应,改变CO或CO2的浓度,相当于改变压强,平衡不移动,所以φ1=φ2,正确;C项,因为乙中气体分子数多,所以p1<p2,正确;D项,由于平衡是从不同途径建立的,所以α1+α2=1,错误。②K=
,由此可得,c1<c2,3c1=2c2,错误;B项,由于该反应为等体积反应,改变CO或CO2的浓度,相当于改变压强,平衡不移动,所以φ1=φ2,正确;C项,因为乙中气体分子数多,所以p1<p2,正确;D项,由于平衡是从不同途径建立的,所以α1+α2=1,错误。②K=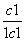 =2,解得c1≈0.67 mol·L-1。φ1=
=2,解得c1≈0.67 mol·L-1。φ1=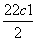 ×100%≈33.3%。容器乙中平衡常数K′=
×100%≈33.3%。容器乙中平衡常数K′= =
=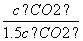 =
=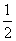 ,c(CO2)=0.5 mol·L-1。则容器乙中的CO的转化率α2=
,c(CO2)=0.5 mol·L-1。则容器乙中的CO的转化率α2=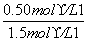 ×100%≈33.3%。
×100%≈33.3%。
答案 (1) (2)A (3)0.062 5 (4)①BC
(2)A (3)0.062 5 (4)①BC
②0.67 mol·L-1 33.3% 33.3%


科目:高中化学 来源: 题型:
工业生产钠和烧碱的原理如下:
①电解熔融氯化钠制钠:2NaCl(熔融)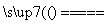 2Na+Cl2
2Na+Cl2
②电解饱和食盐水制烧碱:2NaCl+2H2O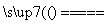 2NaOH+H2+Cl2
2NaOH+H2+Cl2
下列有关说法正确的是 ( )。
A.在反应①和②中,氯化钠均既是氧化剂,又是还原剂
B.在反应①中氯气是还原产物,在反应②中氢气是还原产物
C.若标准状况下生成等体积的气体,则反应①和②中转移电子总数相等
D.若消耗等质量的氯化钠,则反应①和②中转移电子总数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机化合物A的结构简式如下:
(1)A的分子式是__________________。
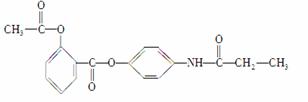
(2)A在NaOH水溶液中充分加热后,再加入过量的盐酸酸化后,可得到B、C、D和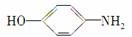 四种有机物,且相对分子质量大小关系为B>C>D。则B、C、D的结构简式分别是:B____________________;C________________;D__________________。
四种有机物,且相对分子质量大小关系为B>C>D。则B、C、D的结构简式分别是:B____________________;C________________;D__________________。
(3)下列物质中,不能与B发生化学反应的是(填序号)________。
①浓H2SO4和浓HNO3的混合液 ②CH3CH2OH(酸催化) ③CH3CH2CH2CH3 ④Na ⑤浓溴水
(4)在B的同分异构体中,属于1,3,5三取代苯的化合物的结构简式为
________________________________________________________________________。
(5)写出B与碳酸氢钠反应的化学方程式:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有如下结构的一种有机物。请根据化合物的结构简式回答问题:
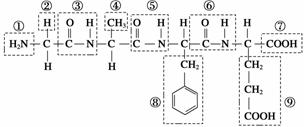
(1)该化合物中,官能团⑦的名称是________,官能团①的电子式是________。
(2)该化合物是由________个氨基酸分子脱水形成的。分子结构中含有________个肽键,称为________肽。
(3)写出该化合物水解生成的氨基酸的结构简式(任写一种):________,写出此氨基酸与氢氧化钠溶液反应的化学方程式:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
高温及催化剂作用下,某反应的平衡常数K= 。恒容时,温度升高,H2浓度减小,下列说法正确的是 ( )。
。恒容时,温度升高,H2浓度减小,下列说法正确的是 ( )。
A.恒温下,将容器体积变为原来2倍,CO的平衡浓度变为原来的1/2
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,正反应速率减小,逆反应速率增大
D.该反应化学方程式为CO2+H2 CO+H2O ΔH<0
CO+H2O ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,我国北京等地出现严重雾霾天气,据研究,雾霾的形成与汽车排放的CO、NO2等有毒气体有关。对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体,反应方程式为4CO(g)+2NO2(g)===4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1。对于该反应,温度不同(T2>T1)其他条件相同时,下列图像正确的是 ( )。
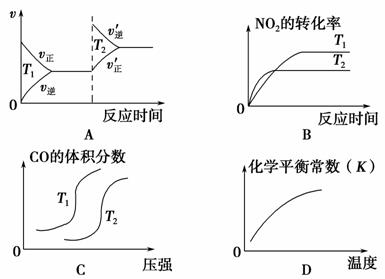
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,将1 mol A和1 mol B气体充入2 L密闭容器,发生反应:A(g)+B(g)xC(g)+D(s) ΔH>0,t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确的是 ( )。

A.t1~t3间该反应的平衡常数均为4
B.反应方程式中的x=1
C.t2时刻改变的条件是使用催化剂
D.t3时刻改变的条件是移去少量物质D
查看答案和解析>>
科目:高中化学 来源: 题型:
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是 ( )。
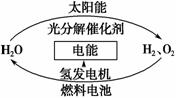
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.2 mol H2O具有的总能量低于2 mol H2和1 mol O2的能量
D.氢气不易贮存和运输,无开发利用价值
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法错误的是
A.一定条件下,2molSO2和1molO2混合在密闭容器中
充分反应后容器中的分子数大于2NA
B.256g S8分子中含S-S键为7NA个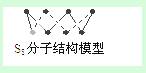
C.由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个
D.1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com