
【题目】乙烯的产量是衡量一个国家石油化工发展水平的重要标志之一,以乙烯为原料合成的部分产品如图所示。下列有关说法正确的是( )

A.氧化反应有①⑤⑥,加成反应有②③
B.氯乙烯、聚乙烯都能使酸性KMnO4溶液褪色
C.反应⑥的现象为产生砖红色沉淀
D.③的反应条件为浓硫酸、加热
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池在充放电过程中表现出了良好的循环稳定性,具有较长的循环寿命,放电时的反应为:LixC6+Li1-xFePO4=6C+LiFePO4 。某磷酸铁锂电池的切面如下图所示。下列说法错误的是
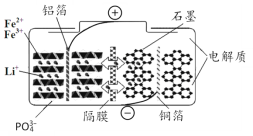
A.放电时Li+脱离石墨,经电解质嵌入正极
B.隔膜在反应过程中只允许Li+ 通过
C.充电时电池正极上发生的反应为:LiFePO4-xe-= Li1-xFePO4+xLi+
D.充电时电子从电源经铝箔流入正极材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙二胺(![]() )是一种有机化合物,分子中氮、碳的杂化类型分别是__________、__________。。乙二胺能与
)是一种有机化合物,分子中氮、碳的杂化类型分别是__________、__________。。乙二胺能与![]() 、
、![]() 等金属离子形成稳定环状离子,其原因是__________,其中与乙二胺形成的化合物稳定性相对较高的是__________(填“
等金属离子形成稳定环状离子,其原因是__________,其中与乙二胺形成的化合物稳定性相对较高的是__________(填“![]() ”或“
”或“![]() ”)。
”)。
(2)![]() 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的![]() 的结构式为__________,其中
的结构式为__________,其中![]() 的配位数为__________。
的配位数为__________。
(3)![]() 和
和![]() 与卤化氢的反应相似,产物的结构和性质也相似。下列对
与卤化氢的反应相似,产物的结构和性质也相似。下列对![]() 与
与![]() 反应产物的推断正确的是__________(填序号)。
反应产物的推断正确的是__________(填序号)。
a 不能与![]() 反应
反应
b 含离子键、共价键
c 能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
|
|
|
|
|
| |
熔点/℃ | -85.5 | 115.2 | >600 | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | (分解) | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)根据价层电子对互斥理论,![]() 、
、![]() 、
、![]() 的气态分子中,中心原子价层电子对数不同于其他分子的是__________。
的气态分子中,中心原子价层电子对数不同于其他分子的是__________。
(2)气态三氧化硫以单分子形式存在,其分子的立体构型为__________形,其中共价键的类型有__________种;固体三氧化硫中存在如图所示的三聚分子,该分子中![]() 原子的杂化轨道类型为__________。
原子的杂化轨道类型为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HA溶液所得滴定曲线如图。下列说法不正确的是

A.HA的电离平衡常数Ka=10-5
B.点①所示的溶液中:2c(Na+)=c(A-)+c(HA)
C.点③所示的溶液中:c(HA)>c(OH-)-c(H+)
D.点④所示的溶液中:2c(OH-)-2c(H+)=c(A-)+3c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物,请回答下列问题:

(1)冷凝管所起的作用为冷凝回流和导气,冷凝水从___口进入(填“a”或“b”)。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。III中小试管内苯的作用是___。
(3)能说明苯与液溴发生了取代反应的现象是___。
(4)三颈烧瓶中发生反应的化学方程式为___,反应结束后使I中的水流入II中,操作是___。
(5)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液;②用5%的NaOH溶液洗涤,振荡,分液;③用蒸馏水洗涤,振荡,分液;④加入无水CaCl2粉末干燥;⑤___(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电动汽车(标志为“![]() ”)在改善城市交通、保护环境等方面的作用至关重要。下列说法不正确的是
”)在改善城市交通、保护环境等方面的作用至关重要。下列说法不正确的是
A. 电动汽车的使用有助于减少氮氧化物的排放
B. 燃油汽车也可以悬挂该标志
C. 电动汽车使用时涉及化学能与电能的转换
D. 电动汽车充电、放电过程均有电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
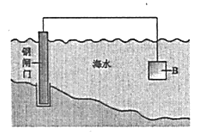
【题目】电化学原理在防止金属腐蚀、能量转换等方面应用广泛。
(1)①钢铁在海水中容易发生电化学腐蚀,正极反应式是__________。
②图中,为减缓钢闸门的腐蚀,材料B可以选择__________(填“Zn”或“Cu”)。
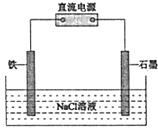
(2)如图为钢铁防护模拟实验装置,则铁做__________极,检测钢铁保护效果的方法是:取少量铁电极附近的溶液于试管中,_________,则说明保护效果好。
(3)氢氧燃料电池是一种新型的化学电源,其构造如图所示:
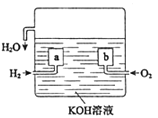
a、b为多孔石墨电极,通入的气体由孔隙中逸出,并在电极表面放电。
①a的电极反应式是_________;
②若电池共产生3.6g水,则电路中通过了_______mol的电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢材料是一类能可逆地吸收和释放氢气的材料。LaNi5合金、NaBH4、H3B-NH3、Mg2NiH4等都是潜在储氢材料。回答下列问题:
(1)基态Ni原子的核外电子排布式为____,有___________个未成对的电子;
(2)NaBH4中H为-1价,Na、B、H电负性由大到小的顺序是_________。BH4-离子的立体构型为________,其中B的杂化轨道类型为_____。
(3)B2H6和NH3化合可以生成H3B-NH3,H3B-NH3加热时发生反应:H3B-NH3=BN+3H2,缓慢释放出H2。BN有类似于石墨的结构,B2H6、NH3和BN的沸点由高到低的顺序为_________, 原因是___。
(4)X-射线衍射分析表明,Mg2NiH4 的立方晶胞的面心和顶点均被Ni原子占据,所有Mg原子的Ni配位数都相等。则Mg原子填入由Ni原子形成的_____空隙中(填“四面体”或“八面体”),其空隙占有百分率为_____。
(5)已知Mg2NiH4 晶体的晶胞参数为646.5 pm,液氢的密度为0.0708 g·cm-3。若以材料中氢的密度与液态氢密度之比定义储氢材料的储氢能力,则Mg2NiH4 的储氢能力是液氢的___倍(列出计算式即可)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com