
| A. | 使用过量的乙酸 | B. | 采用边反应边蒸馏的方法 | ||
| C. | 反应采用水浴加热 | D. | 用氢氧化钠溶液提纯乙酸丁酯 |
分析 实验室用乙酸和丁醇在浓硫酸作用下加热发生酯化反应制备乙酸丁酯,为可逆反应,反应总浓硫酸起到吸水剂和催化剂作用,为提高丁醇的转化率,可使用过量的乙酸,结合酯类的性质解答该题.
解答 解:A.酯化反应为可逆反应,使用过量的乙酸,可增大丁醇的转化率,故A正确;
B.边反应边蒸馏,导致乙酸、丁醇挥发,产率较低,应用冷凝回流的方法,故B错误;
C.水浴加热温度较低,不能超过100℃,应直接加热,故C错误;
D.乙酸丁酯在氢氧化钠溶液中水解,一般可用碳酸钠饱和溶液,故D错误.
故选A.
点评 本题考查乙酸丁酯的制备,为高频考点,侧重考查基本操作、基本理论,明确实验原理是解本题关键,注意从操作规范性及物质性质分析评价,易错选项是C,难度中等.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:选择题
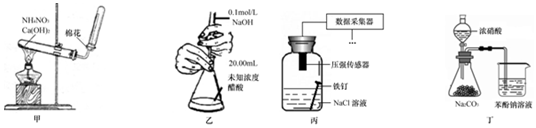
| A. | 用甲装置制取氨气 | |
| B. | 用乙装置测定醋酸浓度 | |
| C. | 用丙装置采集到的压强数据判断铁钉发生电化学腐蚀类型 | |
| D. | 用丁装置验证酸性:硝酸>碳酸>苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 原子序数 | 原子的价电子排布式 | 周期 | 族 |
| 17 | 第三 | ||
| 3d54s1 | ⅥB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾既可用作净水剂,也可用作消毒剂 | |
| B. | 小苏打、氢氧化铝都可用于治疗胃酸过多 | |
| C. | 煤的干馏、石油的分馏都属于化学变化 | |
| D. | 已知PM2.5是指大气中直径小于或等于2.5微米(1微米=1000纳米)的颗粒物,则PM2.5在空气中能形成胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
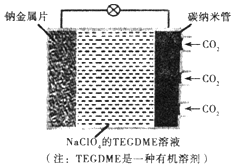 我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2$?_{充电}^{放电}$2Na2CO2+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中).关于该电池,下列说法错误的是( )
我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2$?_{充电}^{放电}$2Na2CO2+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中).关于该电池,下列说法错误的是( )| A. | 充电时,Na+从阳极向阴极移动 | |
| B. | 可以用乙醇代替TEGDME做有机溶剂 | |
| C. | 放电时,当转移lmol电子负极质量减轻23g | |
| D. | 放电时,正极反应为3CO2+4Na++4e-=2Na2CO3+C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
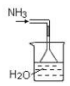 | 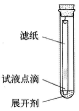 | 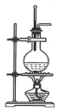 | 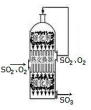 |
| A.吸收多余氨气 | B.Fe3+、Cu2+的分离 | C.酒精和浓硫酸制取乙烯 | D.充分利用反应中的能量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
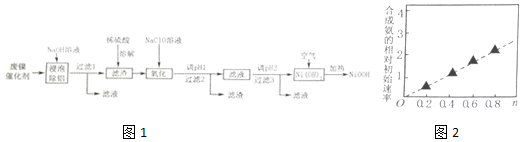
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr3+ | 4.5 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
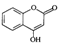 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成.
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成.
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com