
右下图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B的质量数的2.5倍,B元素的原子核内质子数等于中子数,下列叙述不正确的是( )
| B | ||
| A | C |
A. A为ⅤA族元素 B. B为第二周期的元素
C. C是周期表中化学性质最活泼的非金属
D. 三种元素都为非金属元素
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
为测定碳酸氢钠纯度(含有少量氯化钠),学生设计了如下几个实验方案(每个方案均称取m1 g样品),请回答每个方案中的问题。
[方案I]选用重量法进行测定:可用下图中的装置进行实验。

(1)A装置中NaOH溶液的作用是__________ _______,若直接向试样溶液中鼓人空气会导致实验测定结果________(填“偏高”、“偏低”或“无影响”)
(2)该方案需直接测定的物理量是 。
[方案II]选用滴定法进行测定:
 (3)称取m1 g样品,配成100mL溶液,取出20mL,用cmol/L的标准HCl溶液滴定,消耗体积为v mL,则该试样中碳酸氢钠质量分数的计算式为:
(3)称取m1 g样品,配成100mL溶液,取出20mL,用cmol/L的标准HCl溶液滴定,消耗体积为v mL,则该试样中碳酸氢钠质量分数的计算式为:
[方案III]选用气体体积法进行测定:可用右图中的装置进行实验。
(4)为了减小实验误差,量气管中加入的液体X为
(5)通过实验,测得该试样中碳酸氢钠质量分数偏低,产生这种现象的原因可能是_________
a.测定气体体积时未冷却至室温
b.测定气体体积时水准管的水面高于量气管的水面
c.Y型管中留有反应生成的气体
d.气体进入量气管前未用浓硫酸干燥
[方案IV]其操作流程如下:
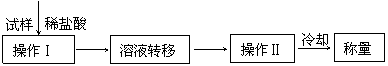
(6)操作Ⅱ的名称是________________________
(7)实验中需要的仪器有电子天平、蒸发皿、玻璃棒等,还需要的玻璃仪器是 ,
(8)在转移溶液时,如溶液转移不完全,则碳酸氢钠质量分数的测定结果_________(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
在1 L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol•L-1和1.5 mol•L-1,现向该溶液中加入39.2 g铁粉使其充分反应。下列有关说法正确的是( )
A.反应后溶液中Fe3+物质的量为0.8 mol
B.反应后产生13.44 L H2(标准状况)
C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol
D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
铍元素性质与铝元素性质相似,下列方法能证明氯化铍由共价键构成的是( )
A.溶于水加硝酸银溶液,观察是否有白色沉淀生成
B.溶于水做导电实验,观察是否导电
C.熔融状态,做导电实验,观察是否导电 D.测定氯化铍熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl。下列“水” 电池在海水中放电时的有关说法正确的是( )
A.正极反应式:Ag+Cl--e-===AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质在水溶液中的电离方程式书写正确的是( )
A.CO2+H2O  ?HCO3-+H+
?HCO3-+H+
B.NaHSO4===Na++HSO4-
C.H3PO4?? 3H++PO43-
3H++PO43-
D.HS-+H2O?? S2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;
则有:Ka·Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变 。
A.①④ B. ①②④
C.①②④⑤ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com