
| A. | S2-的结构示意图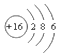 | B. | NH3结构式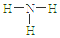 | C. | CO2的电子式: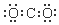 | D. | HCl电子式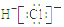 |
分析 A、硫离子的核内有16个质子,核外有18个电子;
B、N原子分别与三个H原子形成三条共价键;
C、二氧化碳中C原子和两个O原子间存在碳氧双键;
D、HCl是共价化合物.
解答 解:A、硫离子的核内有16个质子,核外有18个电子,故硫离子的结构示意图为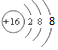 ,故A错误;
,故A错误;
B、N原子分别与三个H原子形成三条共价键,故氨气的结构式为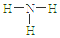 ,故B正确;
,故B正确;
C、二氧化碳中C原子和两个O原子间存在碳氧双键,故二氧化碳的电子式为 ,故C错误;
,故C错误;
D、HCl是共价化合物,H原子和Cl原子间为共价键,故电子式为 ,故D错误.
,故D错误.
故选B.
点评 本题考查了常见的共价化合物和离子化合物的电子式的书写,应在书写电子式之前显判断物质的化学键的类型.


科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| B. | 水溶液中导电能力差的电解质一定是弱电解质 | |
| C. | 在稀的水溶液中,强电解质近乎全部以离子的形态存在,一定不存在电解质分子 | |
| D. | 强电解质都是离子化合物,而弱电解质都是共价化介物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
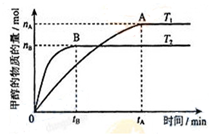 甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下
甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示.
如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
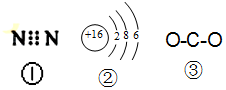
| A. | 图中的①是N2的电子式 | |
| B. | 图中的②是S2-的结构示意图 | |
| C. | 质子数为53,中子数为78的碘原子:13153I | |
| D. | 图 ③为CO2的结构式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水和溴化钾溶液反应:Cl2+2Br-═2Cl-+Br2 | |
| B. | 碳酸钙和稀盐酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 盐酸和氢氧化钠溶液反应:H++OH-═H2O | |
| D. | 铝和氢氧化钠溶液反应:Al+2H2O+OH-═AlO2-+2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com