
【题目】Ⅰ.据报道,日常生活中,将洁厕液与84消毒液混合使用会发生中毒的事故。
(1)84消毒液的主要成分是次氯酸钠,次氯酸钠与空气中CO2反应生成次氯酸,写出次氯酸钠的电子式:__________;若将84消毒液长期露置于空气中,溶液中的主要成分将变为__________(填化学式)。
(2)洁厕灵的主要成分是HCl。洁厕液与84消毒液混合后会发生氧化还原反应,生成有毒的氯气。写出该反应的离子方程式:______________________________。
(3)下列氧化还原反应中,与上述反应类型不同的是________。
A.Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O B.2FeCl3+Fe===3FeCl2
C.S+2H2SO4(浓)![]() 3SO2↑+2H2O D.KClO3+5KCl+3H2SO4===3K2SO4+3Cl2↑+3H2O
3SO2↑+2H2O D.KClO3+5KCl+3H2SO4===3K2SO4+3Cl2↑+3H2O
II.已知高锰酸钾(硫酸酸化)溶液和草酸(H2C2O4)溶液可以发生氧化还原反应。请回答下列问题:
(1)该反应中的还原剂是________(填化学式)。
(2)写出该反应的离子方程式:____________________________________________。
(3)若生成1molCO2则转移电子_______mol
【答案】![]() NaCl ClO-+Cl-+2H+===Cl2↑+H2O A H2C2O4 2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O 1mol
NaCl ClO-+Cl-+2H+===Cl2↑+H2O A H2C2O4 2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O 1mol
【解析】
Ⅰ.次氯酸钠是离子化合物,氧原子和氯原子共用1对共用电子对;84消毒液的主要成分是NaCl和NaClO,有效成分是NaClO,长期露置于空气中,次氯酸钠与空气中二氧化碳反应生成碳酸钠、次氯酸和水,次氯酸遇光分解生成氧气和盐酸,盐酸与碳酸钠反应生成氯化钠、二氧化碳和水;洁厕灵的主要成分是盐酸,盐酸与NaClO发生归中反应,生成氯化钠、氯气和水;盐酸与NaClO发生归中反应,归中反应是同种元素既被氧化又被还原,同种元素变化后的化合价相等。II.高锰酸钾具有强氧化性,在硫酸酸化条件下将H2C2O4氧化为CO2,自身被还原为MnSO4,反应中草酸是还原剂,高锰酸钾是氧化剂,反应中转移电子数目为10mol。
Ⅰ.(1)次氯酸钠是离子化合物,氧原子和氯原子共用1对共用电子对,电子式为:![]() ;84消毒液的主要成分是NaCl和NaClO,有效成分是NaClO,长期露置于空气中,发生反应:2NaClO+CO2+H2O=Na2CO3+2HClO,2HClO2
;84消毒液的主要成分是NaCl和NaClO,有效成分是NaClO,长期露置于空气中,发生反应:2NaClO+CO2+H2O=Na2CO3+2HClO,2HClO2![]() 2HCl+O2↑,Na2CO3+2HCl=
2HCl+O2↑,Na2CO3+2HCl=
2NaCl+CO2↑+H2O,故最终会变为NaCl溶液。(2)次氯酸钠有强氧化性,盐酸有强还原性,盐酸与NaClO反应生成氯化钠、氯气和水,反应的离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O;(3)盐酸与NaClO发生归中反应,归中反应是同种元素既被氧化又被还原,同种元素变化后的化合价相等,反应中硫元素既被氧化又被还原,反应后硫元素的化合价不相等,A错误;反应中铁元素既被氧化又被还原,反应后铁元素的化合价相等,B正确;反应中硫元素既被氧化又被还原,反应后硫元素的化合价相等,C正确;反应中氯元素既被氧化又被还原,反应后硫元素的化合价相等,D正确,故选A。II.(1)高锰酸钾具有强氧化性,在硫酸酸化条件下将H2C2O4氧化为CO2,自身被还原为MnSO4,反应中草酸是还原剂,高锰酸钾是氧化剂;(2)在硫酸酸化条件下,高锰酸钾与H2C2O4反应生成硫酸钾、硫酸锰、CO2、水,反应中转移电子数目为10mol,反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;(3)由方程式可知,生成10mol CO2,反应中转移电子数目为10mol,则生成1mol CO2,反应中转移电子数目为1mol。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水量的关系如下图所示:

现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶液 | 溶质的物质的量浓度 | 溶液的密度/g·cm-3 |
硫酸 | 4 mol·L-1 | ρ1 |
2 mol·L-1 | ρ2 | |
氨水 | 4 mol·L-1 | ρ3 |
2 mol·L-1 | ρ4 |
(1)ρ1、ρ2、ρ3、ρ4由大到小的顺序为:________。
(2)表中2 mol·L-1氨水的质量分数为:________。
(3)将4 mol·L-1的氨水与2 mol·L-1的硫酸等体积混合,所得溶液呈______性(填“酸”、“碱”、“中”);溶液中离子浓度从大到小的顺序是:___________________。
(4)将20%的硫酸与10%的硫酸等体积混合,所得硫酸溶液的质量分数是______。
A.>15% B.=15% C.<15% D.无法判断
(5)100g浓度为4 mol·L-1的硫酸溶液与_____mL水混合,可以使硫酸的物质的量浓度减小到2 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“二![]() 英”是二苯基1,4二氧六环及其衍生物的通称,其中一种毒性最大的结构是
英”是二苯基1,4二氧六环及其衍生物的通称,其中一种毒性最大的结构是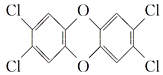 ,关于这种物质的叙述中不正确的是( )
,关于这种物质的叙述中不正确的是( )
A. 该物质不属于芳香族化合物
B. 该物质是一种卤代烃
C. 1 mol该物质最多可与6 mol H2在一定的条件下发生反应
D. 该物质分子中所有原子可能处在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶3 B. 5∶4 C. 1∶1 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
半导体材料磷化硼(BP)可由BBr3和PBr3在高温下合成。回答下列问题:
(1)基态P原子的价电子排布式为__________,同周期中第一电离能比P 小的元素有______种。
(2)在水中的溶解度BBr3_______PBr3(填“ >”或“ <”),原因是_____________。
(3)一定温度下PBr5能形成阴、阳离子个数比为1:1的导电熔体,经测定其中P—Br键键长均相等。写出该导电熔体中阳离子的电子式:_________,其中P原子的杂化轨道类型是_______。
(4)已知磷化硼晶体中P原子作A1型最密堆积,B原子填入四面体空隙中,相邻P原子和B原子核间距为d cm,则该晶体中每个B原子周围有_____个B原子与它距离最近,晶体密度为____g·cm-3(NA表示阿伏加德罗常数的值),若某个P原子的坐标为(0,0,0),则晶胞中其余P原子的坐标为__________(写出一个即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答。
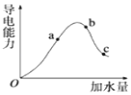
①a、b、c三点的氢离子浓度由小到大的顺序为______。
②a、b、c三点中,醋酸的电离程度最大的一点是______。
③测得某醋酸溶液中氢离子浓度为0.004molL﹣1,则醋酸的电离度为_____,该温度下醋酸的电离平衡常数K=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
以芳香烃A为原料发生如下图所示的变化,可以合成两种高聚物G和H。已知:两个羟基连在同一碳原子上不稳定,会自动脱水。

回答下列问题:
(1)A 中官能团的名称是_____________;C的结构简式为_____________。
(2)B→C的反应条件是____________,D→E的反应类型是_______________。
(3)写出E→G 的化学方程式:_____________________。
(4)E的同分异构体中,苯环上有4 个取代基、遇FeCl3溶液显紫色且能与碳酸氢纳溶液反应生成 CO2的共 有__________种(不考虑立体异构),其中核磁共振氢谱显示有4 种不同化学环境的氢的结构简式为_____________(写出一种即可)。
(5)参照上述合成路线,以丙炔为原料(无机试制任选),设计可降解塑料聚乳酸(PLA)的合成路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com