
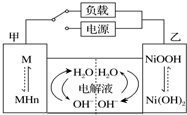
 发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,电解液为碱液(主要为KOH)(见图).镍氢电池充放电原理总反应式为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.下列有关混合动力车的判断正确的是( )
发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,电解液为碱液(主要为KOH)(见图).镍氢电池充放电原理总反应式为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.下列有关混合动力车的判断正确的是( )| A. | 在刹车和下坡时,甲电极的电极反应式为:H2+2OH--2e-═2H2O | |
| B. | 在上坡或加速时,甲电极周围溶液的pH将减小 | |
| C. | 在上坡或加速时,溶液中的K+向甲电极迁移 | |
| D. | 在刹车和下坡时,乙电极增重 |
分析 A、电解池的阴极上水得电子发生还原反应;
B、在上坡或加速时,放电过程为原电池,根据甲中的电极反应来分析pH;
C、放电过程为原电池,原电池工作时,溶液中的阳离子向正极迁移;
D、在刹车和下坡时,乙电极为阳极,是氢氧化镍转化为NiOOH的过程.
解答 解:A、在刹车和下坡时电池处于充电状态即电解池的工作原理,甲电极是阴极,氢离子发生得电子发生还原反应,电极反应式为2H2O+2e-=H2↑+2OH-,故A错误;
B、混合动力车上坡或加速时,属于原电池的工作原理,电动机提供推动力,是电池放电,由图转化关系可知,NiOOH转变为Ni(OH)2,电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,而甲电极周围氢气失去电子变氢离子,所以氢离子浓度变大,溶液的pH将减小,故B正确;
C、放电过程为原电池,原电池工作时,溶液中的阳离子钾离子向,正极即乙电极迁移,故C错误;
D、在刹车和下坡时,属于电解池的工作原理,乙电极为阳极,是氢氧化镍转化为NiOOH的过程,电极质量减轻,故D错误;
故选B.
点评 本题考查学生原电池和电解池的工作原理知识,注意平时知识的积累以及基础知识的掌握,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | KAl(SO4)2溶液:c(SO42-)>(K+)=c(Al3+ )>c(H+)>c(OH-) | |
| B. | NaHCO3溶液:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) | |
| C. | Na2S溶液:c(OH-)-(H+)=c(HS-)+c(H2S) | |
| D. | CH3COONa与 HCl混合后呈中性的溶液:c(Na+)>c(Cl-)=c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0×10-3 mol•L-1盐酸的pH=3.0,1.0×10-7.5 mol•L-1盐酸的pH=7.5 | |
| B. | 在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 在醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a>b | |
| D. | 若1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | |||
| M | X | Z |
| A. | 钠与Z可能形成只含离子键的Na2Z、Na2Z2化合物 | |
| B. | X的最高价氧化物不与任何酸反应 | |
| C. | Y的最简单气态氢化物的热稳定性比X的强,因为Y的最简单气态氢化物分子间存在氢键 | |
| D. | M的简单离子半径是同周期中简单离子半径最小的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 在硅酸钠溶液中滴入稀盐酸,溶液变浑浊. | 非金属性:Cl>Si |
| B | C2H5Br与Br2的溶液混合中加入Na2SO3溶液充分振荡后分液 | 除去C2H5Br中的溴 |
| C | 向某溶液中加氯化钡溶液产生白色沉淀,再加稀硝酸沉淀不消失 | 说明原溶液中一定含有 SO42- |
| D | 向无水乙醇中加入浓H2SO4,加热至170°C产生的气体通入酸性KMnO4溶液,红色褪去 | 证明生成的气体全部是 乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=4的氯化铵溶液中,c(H+)=c(NH3•H2O)=1×10-4mol•L-1 | |
| B. | 由CH3COOH与CH3COONa组成的pH=5.6的混合溶液中:c(Na+)<c(CH3COO-) | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-) | |
| D. | pH相同的①NaOH ②NaClO两种溶液中水的电离程度:①<② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
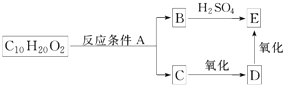
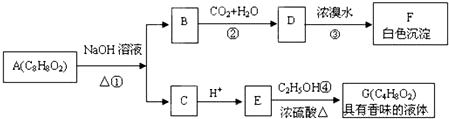
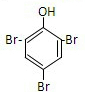 .
.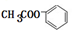 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$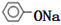 +CH3COONa+H2O.
+CH3COONa+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
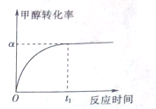 乙酸是重要的有机化工原料,可由乙烯氧化法、甲醛羟基化法等方法生产.回答下列问题:
乙酸是重要的有机化工原料,可由乙烯氧化法、甲醛羟基化法等方法生产.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com