
【题目】用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如下图所示(a、b为石墨电极).下列说法中,正确的是
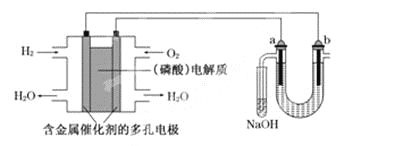
A. 电池工作时,正极反应式为: O2+2H2O+4e-===4OH-
B. 电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
C. 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D. 忽略能量损耗,当电池中消耗0.02 g H2时,b极周围会产生0.04 g H2
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作燃料。
I.工业上利用CO生产燃料甲醇。已知2H2(g)+CO(g) CH3OH(g),则:
(1)在恒温恒容的刚性容器中进行该反应,能说明达到平衡状态的是____。(选填字母序号)
a.混合气体密度不再改变
b.混合气体平均摩尔质量不再改变
c.H2、CO、CH3OH的浓度之比为2:1:1
d.单位时间内消耗1molCO的同时生成2molH2
(2)在密闭容器中按物质的量之比为2:1充入H2和CO,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示。
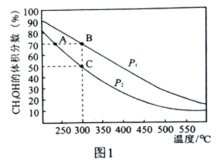
①逆反应速率:v逆(A)__v正(B)(填“>”、“<”或"=”)
②C点时,H2的平衡转化率为________________,该反应的平衡常数Kp=____kPa-2(用含p2的代数式表达,KP为用气体平衡分压代替气体平衡浓度表示的平衡常数,气体分压=气体总压×气体的物质的量分数)。
II.甲醇水蒸气重整制氢(SRM)系统简单,产物中H2含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池的理想氢源。反应如下:
反应i(主):CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H1=+49kJ·mol-1
反应ii(副):H2(g)+CO2(g) CO(g)+H2O(g) △H2=+41kJ·mol-1
温度高于300°C则会同时发生反应iii:CH3OH(g) CO(g)+2H2(g) △H3
(3)计算△H3=____________.
(4)升温将有利于提高CH3OH转化率,但也存在一个明显的缺点是____________。
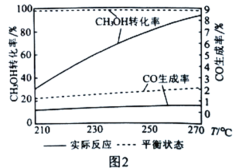
(5)催化剂可以改变化学反应速率,但也存在着一种特性叫“催化剂的选择性”。图2为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。随着温度的升高,CO的实际反应生成率与平衡状态生成率相差越来越大的原因是催化剂对____________(填“反应i”或"反应ii”)的选择性低。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国研究人员结合实验与计算机模拟结果,揭示了在金催化剂表面上水煤气变换的反应历程(如图所示),其中吸附在金催化剂表面上的物质用·标注。下列说法正确的是
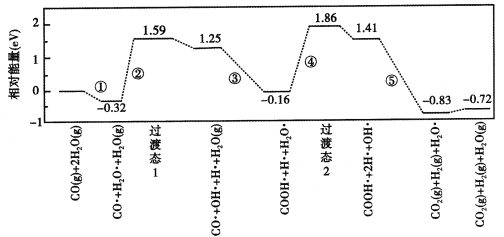
A.水煤气变换反应的△H<0
B.该历程中最大能垒(活化能)E正=1.70 eV
C.步骤⑤只有H-H键和H-O键形成
D.步骤③的转化关系可表示为:CO·+OH·+H2O(g)=COOH·+H2O·
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池构造如图所示,下列叙述正确的是( )

A. 在外电路中,电子由银电极流向铜电极
B. 取出盐桥后,电流表的指针仍发生偏转
C. 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g
D. 原电池的总反应式为Cu+2AgNO3===2Ag+Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解物质的量浓度相同、体积比为1∶3的 CuSO4和 NaCl的混合溶液,可能发生的反应有( )
①2Cu2++2H2O![]() 2Cu+4H++O2↑
2Cu+4H++O2↑
②Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
③2Cl-+2H+![]() H2↑+Cl2↑
H2↑+Cl2↑
④2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
A. ①②③B. ①②④C. ②③④D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3、NO、NO2都是常见重要的无机物,是工农业生产、环境保护、生命科学等方面的研究热点。
(1)写出氨在催化剂条件下与氧气反应生成NO的化学方程式_____。
(2)氮氧化物不仅能形成酸雨,还会对环境产生的危害是形成_____。
(3)实验室可用Cu与浓硝酸制取少量NO2,该反应的离子方程式是_____。
(4)为了消除NO对环境的污染,根据氧化还原反应原理,可选用NH3使NO转化为两种无毒气体(其中之一是水蒸气),该反应需要催化剂参加,其化学方程式为_____。
(5)一定质量的Cu与适量浓硝酸恰好完全反应,生成标准状况下NO2和NO气体均为2240mL。向反应后的溶液中加入NaOH溶液使Cu2+刚好完全沉淀,则生成Cu(OH)2沉淀的质量为_____克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某致病细菌分泌的外毒素,无色,细针状结晶,对小鼠和人体有很强的毒性,可引起流涎、呕吐、便血、痉挛等,以致死亡。该外毒素为环状肽,结构式如图所示,请据图分析回答:

(1)该化合物中含有游离的氨基_____________个,羧基________________个。
(2)该化合物是由_____________个氨基酸组成的,区别这些氨基酸的种类是依靠其结构中的_____________。
(3)组成该化合物的氨基酸有___________种,其中有_____________个氨基酸的R基相同,这个R基是_______________。
(4)该化合物称为环状__________肽化合物,含有___________个肽键。
(5)填写虚线框内结构的名称:A._________________,B.___________________。
(6)该化合物具有8个氮原子,其中_____________个位于肽键上,____________个位于R基上。
(7)该外毒素环肽在形成过程中失去了______________个水分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热△H=﹣890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3kJ/mol
B. 一定条件下,将0.5 molN2和1.5molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ/mol
2NH3(g)△H=﹣38.6kJ/mol
C. 已知2C(s)+2O2(g) ═2CO2(g);△H1;2C(s)+O2(g)=2CO(g) △H2 则△H1>△H2
D. 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电化学的叙述正确的是( )
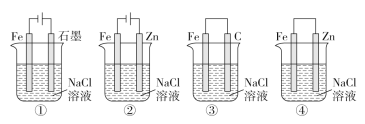
A. 图①两极均有气泡产生,滴加酚酞溶液时石墨一极变红
B. 图②装置中Fe电极参与反应发生腐蚀
C. 图③可以模拟钢铁的吸氧腐蚀,碳棒一极的电极反应式:O2+2H2O+4e-=4OH-
D. 上述4个装置中,图①、②中Fe腐蚀速率较快,图③中Fe腐蚀速率较慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com