
| A. | 测0.1 mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 水滴石穿:CO2+CaCO3+H2O═Ca(HCO3)2 | |
| C. | NH4Cl溶解在T2O中:NH4++T2O?NH3•T2O+H+ | |
| D. | 乙烷的燃烧热为-1559.9 kJ•mol-1,则乙烷燃烧的热化学方程式可表示为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3119.8kJ•mol-1 |
分析 A.根据0.1 mol/L氨水的pH为11,则氨水不完全电离;
B.水滴石穿表示空气中的二氧化碳和水溶解碳酸钙;
C.NH4Cl溶解在T2O中NH4+发生水解显酸性;
D.根据燃烧热指1mol物质完全燃烧生成稳定的化合物所放出的热量书写.
解答 解:A.因为0.1 mol/L氨水的pH为11,则氨水不完全电离,所以电离方程式为:NH3•H2O?NH4++OH-,故A正确;
B.水滴石穿表示空气中的二氧化碳和水溶解碳酸钙生成碳酸氢钙,反应为:CO2+CaCO3+H2O═Ca(HCO3)2,故B正确;
C.NH4Cl溶解在T2O中NH4+发生水解显酸性,水解方程式为:NH4++T2O?NH3•HTO+T+,故C错误;
D.因为燃烧热指1mol物质完全燃烧生成稳定的化合物所放出的热量,又乙烷的燃烧热为-1559.9 kJ•mol-1,所以2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3119.8kJ•mol-1,故D正确;
故选:C.
点评 本题考查方程式的书写,侧重电离、水解、热化学方程式以及化学方程式的考查,明确各反应方程式的书写规律是解答关键,题目难度中等.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:实验题
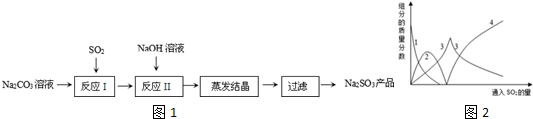
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;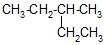 的系统命名为3-甲基戊烷;
的系统命名为3-甲基戊烷; ;
;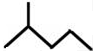 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
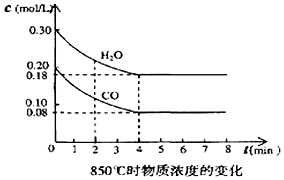 已知:O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1
已知:O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| C. | 锌片插入硝酸银溶液中:Zn+Ag+═Zn2++Ag | |
| D. | 硫酸溶液与氢氧化铜反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 复分解反应 | C. | 置换反应 | D. | 分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
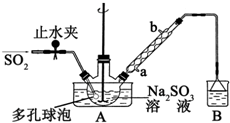 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com