
【题目】关于下列四幅图象与对应描述相符合的是( )
A.![]() 反应中
反应中![]() 的平衡转化率随温度和压强的变化
的平衡转化率随温度和压强的变化
B. 酸性高锰酸钾溶液与草酸反应时
酸性高锰酸钾溶液与草酸反应时![]() 的反应速率随时间变化的图象
的反应速率随时间变化的图象
C.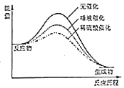 不同催化剂对淀粉水解反应影响的“能量
不同催化剂对淀粉水解反应影响的“能量![]() 反应历程”图象
反应历程”图象
D. 烧碱溶液滴定20mL等浓度醋酸时pH随加入烧碱溶液体积变化的图象
烧碱溶液滴定20mL等浓度醋酸时pH随加入烧碱溶液体积变化的图象
【答案】A
【解析】
A.增大压强平衡逆向移动,转化率减小;升高温度平衡正向移动,转化率增大;
B.![]() 在反应起始时变化不大;
在反应起始时变化不大;
C.催化剂可降低反应的活化能,且唾液比稀硫酸的催化效率高;
D.图中NaOH的pH为12,浓度为![]() ,浓度为
,浓度为![]() 的醋酸溶液的pH应大于2。
的醋酸溶液的pH应大于2。
![]() 增大压强平衡逆向移动,转化率减小;升高温度平衡正向移动,转化率增大,均与图象对应,故A正确;
增大压强平衡逆向移动,转化率减小;升高温度平衡正向移动,转化率增大,均与图象对应,故A正确;
B.![]() 在反应起始时变化不大,一段时候后生成锰离子可作催化剂加快反应速率,开始时与图象不符,故B错误;
在反应起始时变化不大,一段时候后生成锰离子可作催化剂加快反应速率,开始时与图象不符,故B错误;
C.催化剂可降低反应的活化能,且唾液比稀硫酸的催化效率高,则选唾液作催化剂的活化能最小,故C错误;
D.图中NaOH的pH为12,浓度为![]() ,浓度为
,浓度为![]() 的醋酸溶液的pH应大于2,与图象不符,故D错误;
的醋酸溶液的pH应大于2,与图象不符,故D错误;
故选:A。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.图1是实验室用乙醇和浓硫酸制乙烯的发生装置,图2是乙烯性质实验装置,请回答:
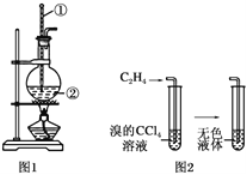
(1)图1中仪器①、②的名称分别为________、________。
(2)请写出实验室制乙烯的化学方程式:________。
(3)向溴的四氯化碳溶液中通入乙烯,溶液的颜色很快褪去,该反应属于________(填反应类型)。
Ⅱ.实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。请回答:
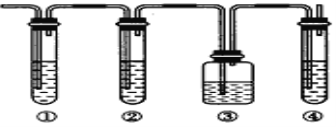
(1)图中①、②、③、④装置盛放的试剂是下列中的(请将下列有关试剂的序号填入对应装置内,可重复选用):①_____②_____③______④________
A.品红溶液 B.氢氧化钠溶液 C.浓硫酸 D.酸性高锰酸钾溶液
(2)能说明二氧化硫气体存在的现象是_______。
(3)使用装置②的目的是________。
(4)使用装置③的目的是________。
(5)验证含有乙烯的现象是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒压、NO和O2的起始浓度一定的条件下发生反应,在相同时间内,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法不正确的是( )

A.反应2NO(g) + O2(g) = 2NO2(g)的H<0
B.图中X点所示条件下,由于测定时间较短,反应未达到平衡
C.从 X→Y 过程中,平衡逆向移动,O2反应量减少
D.380℃下,c 平衡(O2)=5.0×104 mol·L1,NO 平衡转化率为 50%,则平衡常数 K=2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2 和 CH4 转化为高附加值产品CH3COOH 的催化反应历程如图所示:
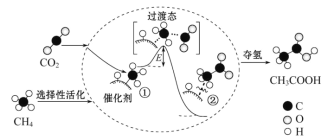
下列说法正确的是
A. 该反应证明任何非自发反应只要条件合适都能进行
B. 反应过程中,只有C—H 键发生断裂
C. 状态①、②之间的能量差即该反应的焓变
D. 合适的催化剂可有效降低活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚邻苯二甲酸二烯丙酯(β聚合物)是一种优良的热固性树脂,这种材料可以采取下列路线合成:
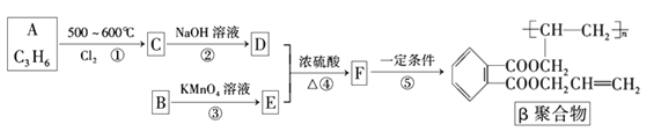
已知:![]()
(1)反应类型:反应①___;反应⑤___。
(2)写出有关反应的方程式:
②__;④__。
(3)G是E的同分异构体,G具有如下性质:
①能发生银镜反应且1molG与银氨溶液反应时最多可得到4molAg;
②遇FeCl3溶液呈紫色;③能够发生水解反应;
符合上述条件的G最多有__种,写出其中苯环上取代基位置均相邻的所有可能的结构简式:___。
(4)工业上可由A为原料经过三步反应制得甘油(![]() ),根据已有知识并结合相关信息,表示出这一合成过程___。
),根据已有知识并结合相关信息,表示出这一合成过程___。
合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3。
CH3COOCH2CH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前海水液化可采用双极膜电液析法、同时获得副产品,其模拟工作原理如图所示。其中双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。M、N为离子交换膜。下列说法正确的是( )

A. X电极为电解池的阴极,该电极反应式为:2H+-2e-=H2↑
B. 电子流向:电源负极→X电极→Y电极→电源正极
C. 电路中每转移1mol电子,X、Y两极共得到标准状况下16.8L的气体
D. M为阳离子交换膜,A室获得副产品NaOH;若去掉B室双极膜,B室产物不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100 ℃时,将0.40 mol二氧化氮气体充入一个2 L抽空的密闭容器中,发生反应:2NO2![]() N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用二氧化氮表示的平均反应速率为_______mol/(L·s)。
(2)该反应的平衡常数K的数值为____。
(3)若在相同条件下最初向该容器中充入四氧化二氮气体,要达到上述平衡状态,四氧化二氮的起始浓度是______mol·L-1。
(4)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2![]() N2O4的平衡常数将_________(填“增大”“减小”或“不变”)。
N2O4的平衡常数将_________(填“增大”“减小”或“不变”)。
(5)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将_______(填“向左移动”“向右移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以C、CO、CO2、CH4等含1个碳原子的物质为原料,可以合成一些化工原料和燃料。
(1)碳原子的核外电子排布式是___,其最外层有___种运动状态不同的电子。
(2)上述物质中属于非极性分子的是___。
(3)合成气(CO和H2)在不同催化剂的作用下,可以合成不同的物质。
①用合成气制备二甲醚时,还产生了一种常温为液态的氧化物,写出制备二甲醚的化学方程式____。
②仅用合成气为原料不可能合成的物质是___(填字母序号)。
a.甲醇 b.乙二醇 c.乙二酸 d.尿素
工业上可用CO2生产燃料甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)+Q(Q>0)。在2L的密闭容器中,发生上述反应:测得n(CO2)和n(CH3OH)随时间变化如图所示。
CH3OH(g)+H2O(g)+Q(Q>0)。在2L的密闭容器中,发生上述反应:测得n(CO2)和n(CH3OH)随时间变化如图所示。

(4)该反应的化学平衡常数的表达式K=___,如果平衡常数K减小,平衡___(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(5)从反应开始到平衡,H2的平均反应速率v(H2)=___。
(6)为了提高CH3OH的产量,理论上可以采取的合理措施有___、___(任写2条措施)。
(7)常温常压下,16g液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,写出该反应的热化学方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com