
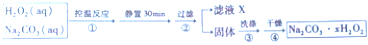
分析 Ⅰ.制备过碳酸钠
双氧水和碳酸钠混合控制温度发生反应2Na2CO3 (aq)+3H2O2 (aq)?2Na2CO3•3H2O2(s),静置过滤得到固体2Na2CO3•3H2O2,将固体洗涤、干燥得到较纯净的2Na2CO3•3H2O2;
(1)根据装置图可知,恒压滴液漏斗中的支管是为了平衡烧瓶和漏斗里的压强,便于漏斗里的液体流下;
(2)温度过高时过碳酸钠分解会导致其产率过低;
(3)过碳酸钠难溶于乙醇,水和乙醇互溶;
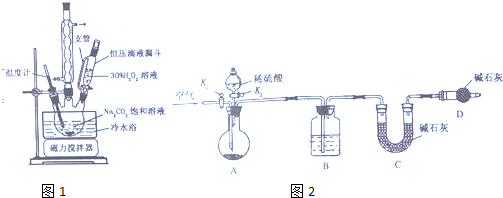
Ⅱ测定是碳酸钠组成
装置A中用Na2CO3•xH2O2与稀硫酸反应生成二氧化碳,装置B将二氧碳干燥,装置C吸收二氧化碳,根据二氧化碳的质量可计算出Na2CO3的质量,结合Na2CO3•xH2O2的质量可确定Na2CO3•xH2O2的组成,为防止空气中水份等对实验的影响,用D装置防止空气中的二氧化碳和水进入C装置,
(4)为了准确测量出二氧化碳的质量,实验结束时要将装置中的二氧化碳全部压到C装置中,据此确定操作;
(5)装置B是干燥二氧碳的,可以用浓硫酸;
(6)实验前后称量装置C的质量,其质量差为△mg,即生成的二氧化碳的质量为△mg,则样品中碳酸钠的质量为$\frac{106}{44}$△mg,双氧水的质量为mg-$\frac{106}{44}$△mg,根据106:34x=$\frac{106}{44}$△mg:(mg-$\frac{106}{44}$△mg)可计算出x;
(7)根据装置图可知,通进装置中的空气未经过除二氧化碳,会导致测得的二氧化碳的质量偏大,则计算出的x偏小,要排除这样的误差,可以将通进装置的空气先经过装有氢氧化钠溶液的洗气瓶.
解答 解:双氧水和碳酸钠混合控制温度发生反应2Na2CO3 (aq)+3H2O2 (aq)?2Na2CO3•3H2O2(s),静置过滤得到固体2Na2CO3•3H2O2,将固体洗涤、干燥得到较纯净的2Na2CO3•3H2O2;
(1)根据装置图可知,恒压滴液漏斗中的支管是为了平衡烧瓶和漏斗里的压强,便于漏斗里的液体流下,
故答案为:平衡烧瓶和漏斗里的压强,便于漏斗里的液体流下;
(2)温度过高时过碳酸钠分解会导致过碳酸钠产率过低,所以温度不能过高,
故答案为:温度过高时过碳酸钠分解会导致过碳酸钠产率过低;
(3)过碳酸钠在无水乙醇中溶解度小于水,且无水乙醇能和水互溶,且极易挥发,所以选用无水乙醇洗涤,所以其目的是:减小过碳酸钠的损耗,利于干燥,
故答案为:减小过碳酸钠的损耗,利于干燥;
Ⅱ测定是碳酸钠组成
装置A中用Na2CO3•xH2O2与稀硫酸反应生成二氧化碳,装置B将二氧碳干燥,装置C吸收二氧化碳,根据二氧化碳的质量可计算出Na2CO3的质量,结合Na2CO3•xH2O2的质量可确定Na2CO3•xH2O2的组成,为防止空气中水份等对实验的影响,用D装置防止空气中的二氧化碳和水进入C装置,
(4)为了准确测量出二氧化碳的质量,实验结束时要将装置中的二氧化碳全部压到C装置中,所以实验结束时,先关闭K2,一段时间后再关闭K1,
故答案为:先关闭K2,一段时间后再关闭K1;
(5)装置B是干燥二氧碳的,可以用浓硫酸,
故答案为:浓硫酸;
(6)实验前后称量装置C的质量,其质量差为△mg,即生成的二氧化碳的质量为△mg,则样品中碳酸钠的质量为$\frac{106}{44}$△mg,双氧水的质量为mg-$\frac{106}{44}$△mg,则106:34x=$\frac{106}{44}$△mg:(mg-$\frac{106}{44}$△mg),所以x=$\frac{44m-106△m}{34△m}$,
故答案为:$\frac{44m-106△m}{34△m}$;
(7)根据装置图可知,通进装置中的空气未除二氧化碳,会导致测得的二氧化碳的质量偏大,则计算出的x偏小,要排除这样的误差,可以将通进装置的空气先经过装有氢氧化钠溶液的洗气瓶,
故答案为:通进装置中的空气未除二氧化碳;通进装置的空气先经过装有氢氧化钠溶液的洗气瓶.
点评 本题考查制备实验方案设计,侧重考查分析、计算及知识迁移、基本操作能力,难点是过碳酸钠组成的计算,解题的关键是准确理解实验原理,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.3NA | |
| B. | 4.48L氨气分子中含有0.6NA个N-H键 | |
| C. | 铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA | |
| D. | 4℃时,18g2H216O中含有共用电子对数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据共价键的强弱规律,推出HF的沸点强于HCl | |
| D. | 根据无机含氧酸的强弱规律,推出HNO2的酸性强于H3PO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | α1=α2>α3 | B. | α1<α2<α3 | C. | α1>α2>α3 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲乙装置连接是a接c、b接d | |
| B. | 甲装置工作时H+ 移向负极 | |
| C. | 乙装置阴极室溶液的pH与电解前相比将升高 | |
| D. | a和c电极都发生CO(NH2)2-6e-+H2O═N2↑+CO2↑+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  装置中阳极上析出红色固体 | B. |  装置中铜片应与电源负极相连 | ||
| C. |  装置中外电路电流方向:b极→a极 | D. |  装中阴极反应:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素的原子半径以ⅤⅡA族的为最大 | |
| B. | 同主族元素两种元素原子的核外电子数的差值可能为26 | |
| C. | 短周期元素中次外层电子数是最外层电子数2倍的原子一定是非金属元素 | |
| D. | 同周期第ⅡA族和ⅢA族元素的原子序数之差不可能为25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com