
【题目】X、Y是元素周期表前20号元素,且X的原子序数比Y大4.
(1)若X的氧化物、氯化物都是实验室常用的干燥剂.
(i)含有X元素的一种盐溶液和Y的一种气态氧化物均是工农业生产中常见的漂白剂,则等物质的量的二者在水溶液中发生反应的化学方程式为
(ii)酸性土壤改变会施用X的一种气态氧化物,但不能与氮肥同时施用,原因为
(2)若X是金属性最强的短周期元素
(i)单质X着火,可用来灭火.
(ii)Y与氢元素能形成一种摩尔质量为43g/mol的共价化合物,已知该物质受到撞击即可放出大量的气体,写出对应的化学方程式:
(3)若X的离子半径是第三周期离子半径最小的
Y与钙元素形成的化合物的电子式为;Y2与NaOH溶液反应的产物之一是OY2 , 该反应的离子方程式为 .
【答案】
(1)SO2+H2O+Ca(ClO)2=CaSO4↓+HClO+HCl;CaO遇水生成碱,铵态氮肥会与碱反应生成NH3 , 而降低肥效
(2)沙子;2HN3 ![]() H2↑+3N2↑
H2↑+3N2↑
(3)![]() ;2F2+2OH﹣=OF2↑+2F﹣+H2O
;2F2+2OH﹣=OF2↑+2F﹣+H2O
【解析】解:(1)若X的氧化物、氯化物都是实验室常用的干燥剂,则X为Ca,X的原子序数比Y大4,可知Y为S,(i)含有X元素的一种盐溶液和Y的一种气态氧化物均是工农业生产中常见的漂白剂,分别为Ca(ClO)2、SO2 , 二者发生氧化还原反应,反应的化学方程式为SO2+H2O+Ca(ClO)2=CaSO4↓+HClO+HCl,所以答案是:SO2+H2O+Ca(ClO)2=CaSO4↓+HClO+HCl;(ii)酸性土壤改变会施用X的一种气态氧化物,但不能与氮肥同时施用,原因是CaO遇水生成碱,铵态氮肥会与碱反应生成NH3 , 而降低肥效,
所以答案是:CaO遇水生成碱,铵态氮肥会与碱反应生成NH3 , 而降低肥效;(2)若X是金属性最强的短周期元素,应为Na,则Y为N元素,(i)钠性质活泼,易与水、氧气反应,与氧气反应生成过氧化钠,过氧化钠和与二氧化碳反应,则钠着火应用沙土扑灭,所以答案是:沙子;(ii)Y与氢元素能形成一种摩尔质量为43g/mol的共价化合物,已知该物质受到撞击即可放出大量的气体,则应为HN3 , 撞击时发生反应的化学方程式为2HN3 ![]() H2↑+3N2↑,
H2↑+3N2↑,
所以答案是:2HN3 ![]() H2↑+3N2↑;(3)若X的离子半径是第三周期离子半径最小的,应为Al,则Y为F元素, Y与钙元素形成的化合物为氟化钙,电子式为
H2↑+3N2↑;(3)若X的离子半径是第三周期离子半径最小的,应为Al,则Y为F元素, Y与钙元素形成的化合物为氟化钙,电子式为 ![]() ;F2与NaOH溶液反应的产物之一是OF2 , 该反应的离子方程式为2F2+2OH﹣=OF2↑+2F﹣+H2O,
;F2与NaOH溶液反应的产物之一是OF2 , 该反应的离子方程式为2F2+2OH﹣=OF2↑+2F﹣+H2O,
所以答案是: ![]() ;2F2+2OH﹣=OF2↑+2F﹣+H2O.
;2F2+2OH﹣=OF2↑+2F﹣+H2O.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
【题目】TiO2在工业生产和日常生活中有重要用途.
(1)工业上用钛铁矿石(FeTiO3 , 含FeO、Al2O3、SiO2等杂质)经过下述反应制得: 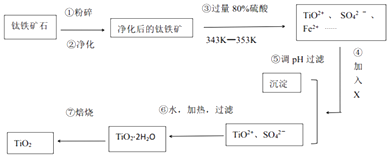
其中,步骤③发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O.
(i)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中两性氧化物发生反应的离子反应方程式: .
(ii)④中加入的X可能是
(iii)④⑤两步的目的是 .
(iv)写出⑥的化学反应方程式 .
(2)TiO2可通过下述两种方法制备金属钛:方法一是先将TiO2与Cl2、C反应得到TiCl4 , 再用镁还原得到Ti.
(i)写出生成TiCl4的化学反应方程式
方法二是电解TiO2来获得Ti(同时产生O2):
将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池.
(ii)阴极反应的电极反应式为 .
(iii)电解过程中需定期向电解槽池中加入碳块的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组向某2L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)D(g)+E(g)△H=QkJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的物质的量如下表:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T1℃时,该反应的平衡常数K=;
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是(填字母编号).
a.通入一定量的B
b.加入一定量的固体A
c.适当缩小容器的体积
d.升高反应体系温度
e.同时加入0.2molB、0.1molD,0.1molE
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为如图中的(填序号) 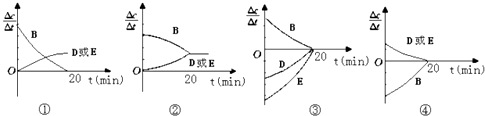
(4)维持容器的体积和温度T1不变,当向该容器中加入1.60molB,0.20molD,0.20molE和nmolA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n取值范围mol.
(5)维持容器的体积和温度T1不变,各物质的起始物质的量为:n(A)=1.0mol,n(B)=3.0mol,n(D)=amol,n(E)=0mol,达到平衡后,n(E)=0.50mol,则a= .
(6)若该密闭容器绝热,实验测得B的转化率B%随时间变化的示意图如图所示由图可知,Q0(填“大于”或“小于”),c点v正v逆(填“大于”、“小于”或“等于”.) 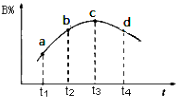
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液X中,可能含有Na+、Cu2+、Mg2+、Al3+、SiO32﹣、AlO2﹣、CO32﹣、Cl﹣中的一种或几种.现取该溶液适量,向其中加入一定物质的量浓度的稀盐酸,产生沉淀的物质的量(n)与加入盐酸的体积(V)的关系如图所示,下列说法中不正确的是( ) 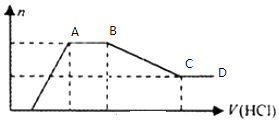
A.溶液X中一定不含Cu2+、Mg2+、Al3+ , 可能含有Cl﹣
B.OA段参加反应的阴离子的物质的量之比为2:1或1:2
C.AB段一定生成了气体
D.BC段发生反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气是一种低热值煤气,主要成分为H2和CO,主要作为工业上合成氨和液体燃料的原料.
(1)反应CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41KJ/mol的v﹣t图象如图1所示,若其他条件不变,只是在反应前缩小体积使压强增大,则其v﹣t图象如图2所示. 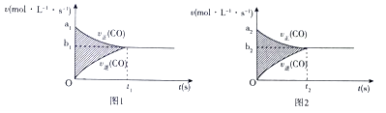
下列说法正确的是
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧图2阴影部分面积更大
A.①④⑤⑦
B.①③⑥⑦
C.②④⑤⑧
D.②④⑤⑦
(2)在一定温度下将C单质和CO2(g)各0.10mol充入体积为1L的恒容密闭容器中发生反应C(s)+CO2(g)2CO(g)△H=+172KJ/mol.
①下列示意图正确且能说明反应在t1时刻已经达到化学平衡状态的是(填序号).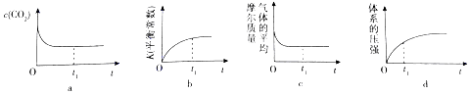
②达到平衡时,容器内的压强为起始时的1.5倍,则此时反应的化学平衡常数K=;若此时再分别加入0.05mol的CO2和0.1mol的CO,则此时平衡将(填“左移”、“右移”或“不移动”.)若将该反应的起始条件改为恒温恒压,则达到平衡时,CO2的转化率将(填“增大”“减小”或“不变”).
(3)工业上用焦炭和水蒸气制备水煤气的热化学方程式为
(4)在一定条件下以CO和H2为原料可以合成乙醇,反应方程式为:2CO(g)+4H2(g)CH3CH2OH(g)+H2O(g)△H=aKJ/mol.
请从反应能否自发进行的角度解释a一定小于0的原因: , 若只改变反应的一个条件,能使平衡体系中n ![]() 增大的措施有(答出两点即可)
增大的措施有(答出两点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的摩尔体积比乙的摩尔体积小
B.甲的物质的量比乙的物质的量多
C.甲的相对分子质量比乙的相对分子质量小
D.甲的分子数比乙的分子数少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2 , 在一定条件下发生如下反应:N2(g)+3H2(g)2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图: 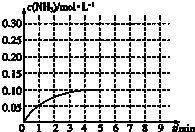
(1)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 .
①0.20molL﹣1 ②0.12molL﹣1 ③0.10molL﹣1 ④0.08molL﹣1
(2)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25molL﹣1),请在如图中画出第5分钟末达到此平衡时NH3浓度的变化曲线 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数,下列说法正确的是( )
A.1 mol氦气中有2NA个氦原子
B.14 g氮气中含NA个氮原子
C.2 L 0.3 molL﹣1 Na2SO4溶液中含0.6 NA个Na+
D.18 g水中所含的电子数为8NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com