
【题目】下列是电解质且能导电的是
A.熔融NaClB.CuC.盐酸D.KNO3晶体
科目:高中化学 来源: 题型:
【题目】
(1)Ⅰ.肉桂酸甲酯由C、H、O三种元素组成,质谱分析其分子的相对分子质量为162,核磁共振氢谱谱图显不有6个峰,其面积之比:1:2:2:1:1:3,利用红外光谱仪检测其中的某些基团,测得红外光谱如下图: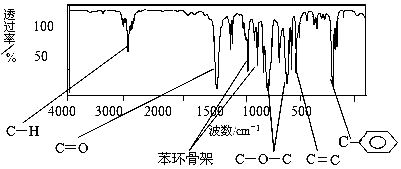
则肉桂酸甲酯的结构简式是(不考虑立体异构)。
(2)Ⅱ.现有2.8g有机物A,完全燃烧生成0.15molCO2和1.8gH2O,A的相对分子质量为56。
已知: ![]() (X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下:
(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下: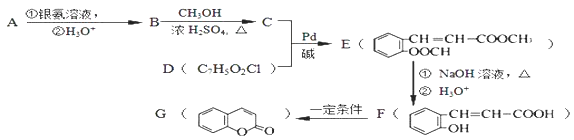
回答下列问题:
①A的分子式为。
②写出C中含氧官能团名称:;F→G 的反应类型是。
③写出A和银氨溶液反应的化学方程式。
④与F互为同类的同分异构体有种(不包括含F本身且不考虑立体异构),写出其中一种具有順反异构的顺式结构的结构简式。
⑤又知: ![]() (R,R′为烃基),试写出以溴苯和丙烯(CH2=CH-CH3)为原料,合成
(R,R′为烃基),试写出以溴苯和丙烯(CH2=CH-CH3)为原料,合成 ![]() 的路线流程图。合成路线的书写格式如下:
的路线流程图。合成路线的书写格式如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列六种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④Al2(SO4)3 ⑤CH3COOH ⑥NaHCO3。
(1)25℃时,0.1mol·L-1②溶液的pH________7(填“>”、“=”或“<”);其原因是______________________________________(用离子方程式表示);
(2)常温下,浓度均为0.1mol/L的③和⑥的溶液中离子种类________(填“相同”或是“不相同”);
(3)将④溶液加热蒸干并灼烧最终得到的物质是____________(填化学式);
(4)常温下0.1 mol/L的⑤溶液加水稀释过程中,下列表达式的数据一定变大的是_________。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 ③能与水在一定条件下反应生成有机物C |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③在Cu作催化剂且加热条件下能与O2反应 |
D | ①由C、H、O三种元素组成;②球棍模型为 ③能与C反应生成相对分子质量为100的酯 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是________________。
(2)写出在一定条件下,A发生聚合反应生成高分子化合物的化学方程式:_____________。
(3)B具有的性质是________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色。
(4)由B制备硝基苯的化学方程式___________________________。
(5)C在铜作催化剂且加热条件下能与氧气反应的化学方程式_________________。
(6)D中官能团的名称为__________________________。
(7)D与C反应能生成相对分子质量为100的酯,该反应的反应类型为____________;其化学方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1mol·L-1的HClO2和1mol·L-1的HMnO4两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得曲线如图所示。下列说法正确的是( )
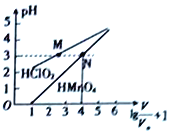
A. 当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
B. 在0≤pH≤5时,HMnO4溶液满足:pH=1g![]()
C. 常温下,浓度均为0.1mol·L-1的NaClO2和NaMnO4溶液的pH:NaMnO4>NaClO2
D. 稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定的温度、压强和钒催化剂存在的条件下,SO2被空气中的O2氧化为SO3。V2O5是钒催化剂的活性成分,郭汗贤等提出:V2O5在对反应I的催化循环过程中,经历了Ⅱ、Ⅲ两个反应阶段,图示如图1:
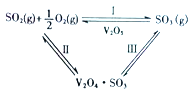
图1
(1)①已知有关气体分子中1mol化学键断裂时需要吸收的能量数据如下:
化学键 | S=O(SO2) | O=O(O2) | S=O(SO3) |
能量/kJ | 535 | 496 | 472 |
由此计算反应Ⅰ的△H=_________kJ·mol-1。
②写出反应Ⅱ的化学方程式_________。
(2)不能说明反应Ⅰ达到平衡状态的是_________。
A.恒容密闭容器中混合气体的压强不再变化
B.恒容密团容器中混合气体的密度不再变化
C.混合气体的总物质的量不再变化
D.混合气体的平均相对分子质量不再变化
E.n(SO2)∶n(O2)∶n(SO3)=2∶1∶2
F.SO2气体的百分含量不再变化
(3)在保持体系总压为105Pa的条件下进行反应SO2+1/2O2![]() SO3,原料气中SO2和O2的物质的量之比m(m=
SO3,原料气中SO2和O2的物质的量之比m(m=![]() )不同时,SO2的平衡转化率与温度(t)的关系如下图所示:
)不同时,SO2的平衡转化率与温度(t)的关系如下图所示:
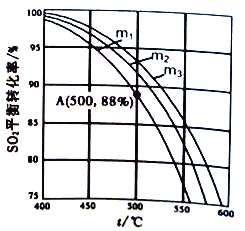
①图中m1、m2、m3的大小顺序为_________,理由是_________。
②反应I的化学平衡常数Kp表达式为_________(用平衡分压代替平衡浓度表示)。图中A点原料气的成分是:n(SO2)=10mol,n(O2)=24.4mol,n(N2)=70mol,达平衡时SO2的分压p(SO2)为_________Pa。(分压=总压×物质的量分数)。
③近年,有人研发出用氧气代替空气的新工艺,使SO2趋于全部转化。此工艺的优点除了能充分利用含硫的原料外,主要还有_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨有“光明使者”的美誉,在自然界中主要以钨(+6价)酸盐的形式存在,黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe、Mn)WO4,钨酸(B)酸性很弱,难溶于水,黑钨矿传统冶炼工艺的第一阶段是碱熔法,第二阶段则是用还原剂还原出金属钨。化合物A、B、C含有同一元素。请回答下列问题:
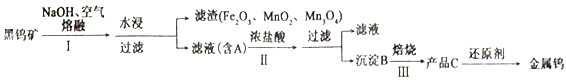
(1)为提高水浸速率,采取的措施为___________________(写两种)。
(2)用还原剂还原出金属钨。
①碳和氢气均可还原化合物C得钨,用氢气比用碳更具有优点,其理由是___________。
②如果用金属铝与化合物C反应,还原出1mol钨至少需要铝的质量为___________。
(3)利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)![]() WI2(g) △H<0。
WI2(g) △H<0。
①一定温度下,向某恒容密闭容器中加入2molI2(g)和足量W(s)达平衡后,I2(g)的转化率为20%,则平衡时c[I2(g)]∶c[WI2(g)]=___________;相同条件下,若开始加入I2(g)的物质的量变为原来2倍,则下列数值是原来2倍的有___________(填标号)。
A.平衡常数 B.达到平衡的时间
C.I2(g)的物质的量浓度 D.平衡时WI2(g)的体积分数
②工业上利用上述反应原理提纯金属钨的示意图如右:
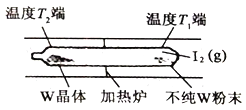
反应在真空石英管中进行,先在温度为T1端放入不纯W粉末和少量I2(g),一段时间后,在温度为T2的一端得到纯净的晶体,则温度T1___________T2(填:“>”、“<”或“=”)。
(4)写出黑钨矿中FeWO4在步骤Ⅰ中反应的化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下:
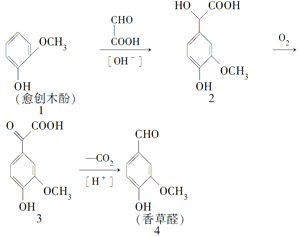
下列说法中正确的是( )
A. 反应1→2中原子利用率为90%
B. 检验制得的香草醛中是否混有化合物3,可用氯化铁溶液
C. 化合物2在一定条件下可发生酯化反应
D. 等物质的量的四种化合物分别与足量NaOH溶液反应,消耗NaOH物质的量之比为1∶4∶3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com