
| A�� | ���ʵ���Ũ����ȵ�CH3COOH��CH3COONa��Һ�������ϣ�2c��H+��+c��CH3COOH��=c��CH3COO-��+2c��OH-�� | |
| B�� | 0.1mol/L pHΪ4��NaHB��Һ�У�c��HB-����c��H2B����c��B2-�� | |
| C�� | ��ˮ�У�c��Cl-����c��H+����c��OH-����c��ClO-�� | |
| D�� | pH=3�Ĵ�����Һ��pH=11������������Һ�������Ϻ�pH=7 |
���� A����Ũ�ȵ����CH3COOH��CH3COONa�����Һ�е���غ�c��CH3COO-��+c��OH-��=c��Na+��+c��H+�������غ�c��CH3COOH��+c��CH3COO-=2c��Na+���������غ���������
B��NaHB 0.1mol/L��PH=4˵��������������ʽ��������˵������̶ȴ���ˮ��̶ȣ�
C����ˮ�д��ڻ�ѧƽ��Cl2+H2O?HCl+HClO�������������
D��pH=3�Ĵ�����Һ��pH=11NaOH��Һ�������ϣ�ƽ��״̬�µ������Ӻ����������ӷ�Ӧ�����ֵ���������ӣ�
��� �⣺A����Ũ�ȵ����CH3COOH��CH3COONa�����Һ�е���غ�c��CH3COO-��+c��OH-��=c��Na+��+c��H+�������غ�c��CH3COOH��+c��CH3COO-=2c��Na+���������غ���Ƶ���2c��H+��+c��CH3COOH��=c��CH3COO-��+2c��OH-������A��ȷ��
B��NaHB 0.1mol/L��PH=4˵��������������ʽ��������˵������̶ȴ���ˮ��̶ȣ�ӦΪc��HB-����c��B2-����c��H2B������B����
C����ˮ�д��ڻ�ѧƽ��Cl2+H2O?HCl+HClO����Һ������Ũ�ȴ�Сc��H+����c��Cl-����c��ClO-����c��OH-������C����
D��pH=3�Ĵ�����Һ��pH=11NaOH��Һ�������ϣ�ƽ��״̬�µ������Ӻ����������ӷ�Ӧ�����ֵ���������ӣ���Ӧ����Һ�����ԣ���D����
��ѡA��
���� ���⿼���˵������Һ������Ũ�ȴ�С�Ƚϡ�������ʵ���ƽ�⡢��Һ�е���غ�͵���غ�ļ���Ӧ�ã����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڷ�Ӧ����������ԭ��Ӧ | |
| B�� | KI��������Ӧ������������� | |
| C�� | KI��������Ӧ���������������� | |
| D�� | ����ҺͻȻ��Ϊ��ɫ����֮�ֺܿ���ʧ����һ������٢ڵķ�Ӧ�����й� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
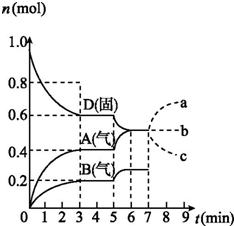 ���ݻ�Ϊ2.0 L���ܱ������ڣ�����D��T��ʱ������Ӧ���䷴Ӧ�������������ʵ�����ʱ��t�ı仯��ϵ��ͼ����������������ǣ�������
���ݻ�Ϊ2.0 L���ܱ������ڣ�����D��T��ʱ������Ӧ���䷴Ӧ�������������ʵ�����ʱ��t�ı仯��ϵ��ͼ����������������ǣ�������| A�� | �ӷ�Ӧ��ʼ����һ�δﵽƽ��ʱ��B���ʵ�ƽ����Ӧ����Ϊ0.033 3 mol/��L•min�� | |
| B�� | ������ͼ�÷�Ӧ��ƽ�ⳣ������ʽΪK=c2��A��•c��B�� | |
| C�� | ���ڵ�5 minʱ�����¶ȣ���÷�Ӧ������Ӧ�����ȷ�Ӧ����Ӧ��ƽ�ⳣ������B�ķ�Ӧ�������� | |
| D�� | ���ڵ�7 ����ʱ����D�����ʵ�����A�����ʵ����仯�������a���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ������� | ��ʼʱ���������ʵ���/mol | ��ƽ��ʱ��ϵ�����ı仯 | ||
| N2 | H2 | NH3 | ||
| �� | 1 | 3 | 0 | �ų�������23.15kJ |
| �� | 0.8 | 2.4 | 0.4 | �ų�������Q |
| A�� | �����١����з�Ӧ��ƽ�ⳣ����ȣ�ƽ��ʱ������ת������� | |
| B�� | ƽ��ʱ������������NH3 �����������Ϊ1/8 | |
| C�� | �������д�ƽ��ʱ�ų�������Q=4.63 kJ | |
| D�� | �������ٸ�Ϊ��ѹ��ϵ������0.25 L He����ƽ��ʱ�ų�����������23.15 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
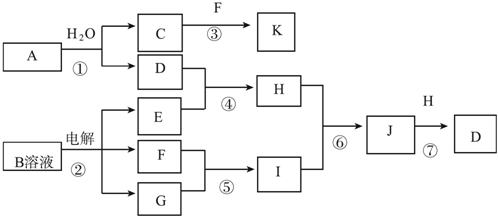
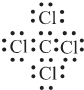 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
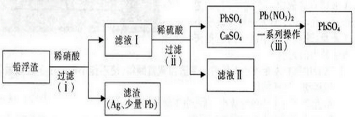
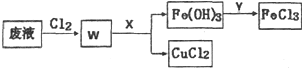 ͭ���仯�����ڹ�ũҵ���������Ź㷺����;��
ͭ���仯�����ڹ�ũҵ���������Ź㷺����;���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ϊ��ʷ�����ϡ����¡���������������ʽʵʩ������Ҫ���û�ѧԭ����Դͷ�ϼ��ٺ�������ҵ�����Ի�������Ⱦ | |
| B�� | ���۱�ը�¹ʾ�Ԯ�����У�����Ա�����ִ�Ž����ơ���ʯ���ױ������������Ȼ�ѧƷ�IJֿ����Ӧ��������ĭ������������� | |
| C�� | ����������֯��Ϊ�����أ��ṹ��ͼ��ʾ�������Ʒ��ǵ�������ű������Ч���ֶΣ����������������Ѿ��������ϰ������� | |
| D�� | ijƷ�ƻ�ױƷ�ڹ���з���ǿ����Ʒ�в����κλ�ѧ�ɷ֣��ǡ�ʮ��רע��Ȼ�����������ʲ�Ʒ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com