
【题目】某元素原子最外层电子层上只有一个电子,该元素
A. 一定是金属元素 B. 可能是金属元素,也可能不是金属元素
C. 一定是ⅠA族元素 D. 一定是非主族元素
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.1000molL﹣1NaOH溶液滴定20.00mL0.1000molL﹣1CH3COOH溶液所得滴定曲线如图,下列说法正确的是( ) 
A.①处水的电离程度大于②处水的电离程度
B.②处加入的NaOH溶液恰好将CH3COOH中和
C.③处所示溶液:c(Na+)<c(CH3COO﹣)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO﹣)>c(H+)>c(Na+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物.冶炼铜的反应为8CuFeS2+21O2 ![]() 8Cu+4FeO+2Fe2O3+16SO2 .
8Cu+4FeO+2Fe2O3+16SO2 .
(1)若CuFeS2中Fe的化合价为+2,反应中被还原的元素是(填元素符号).
(2)用稀H2SO4浸泡上述反应制取铜后剩余的固体残渣,取少量所得溶液,检验溶液中存在 Fe3+的方法是(注明试剂、现象).
(3)上述冶炼过程产生大量SO2 . 下列处理方案中合理的是(填代号) a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(4)验证黄铜矿冶炼铜的反应后气体中含有SO2的方法是 .
(5)实验室制备,收集干燥的SO2 , 所需仪器如下. 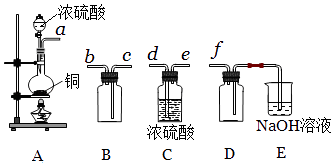
①其中装置A产生SO2 , 反应的化学方程式为 .
②请按气流方向连接各仪器接口,顺序为a→→→→f,
装置E中NaOH溶液的作用是 . E中反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇与氢溴酸反应合成溴乙烷,其装置如下(夹持和加热装置略): 
【查阅资料】NaBr+H2SO4=NaHSO4+HBr
溴乙烷是无色液体,沸点38.4℃,密度1.44g/cm3 .
【合成反应】在a中加入20mL 95%的乙醇和20mL水,在搅拌、冷却下,缓慢加入40mL浓硫酸.再加入30g溴化钠和几粒碎瓷片,d中加入少量冰水并置于冰水浴e中.b中通入冷却水后,小火加热a,直到c处无油滴滴出,结束反应.
【分离提纯】将d中馏出液转入分液漏斗中,静置,将有机层转入另一锥形瓶并置于冰水浴中冷却;在振荡下向有机液中逐滴加入4mL浓硫酸,再用干燥的分液漏斗分去硫酸层.最后通过蒸馏得到纯净的溴乙烷.
请回答下列问题:
(1)冷凝管的进水口是(填字母编号).
(2)a中加入碎瓷片的作用是 . 锥形瓶置于冰水浴中冷却降温的原因是 . 如果d中的馏出液略带橙红色,其中橙红色的物质可用足量饱和NaHSO3溶液洗涤除去,有关反应的离子方程式是 .
(3)本实验的有机副产物可能有(写出其中两种的结构简式).
(4)在第一次分离过程中,有机层从分液漏斗(填“上口倒出”或“下口放出”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.Na2CO3比NaHCO3溶解度大
B.Na2CO3比NaHCO3稳定
C.Na2CO3和NaHCO3都能跟石灰水反应得到白色沉淀
D.物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应得CO2物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 离子化合物中一定含有金属元素
B. 构成物质的分子中一定含有化学键
C. 非极性键也可能存在于离子化合物中
D. 共价化合物中可能含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A.乙烯水化制乙醇;溴乙烷水解制乙醇
B.甲苯使酸性高锰酸钾溶液褪色;丙炔和氢气反应制取丙烷
C.甲苯硝化制TNT;乙炔与氯化氢反应制氯乙烯
D.乙醇脱水制乙烯;溴乙烷脱溴化氢制乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( ) 
A.放电时,负极发生:2AlCl4﹣﹣e﹣=Al2Cl3﹣+Cl﹣
B.充电时,泡沫石墨极与外电源的负极相连
C.放电时,电路中每流过3mol电子,正极减少27g
D.充电时,阴极发生:4Al2Cl3﹣+3e﹣=Al+7AlCl4﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com