
ЁОЬтФПЁПЙЄвЕШМЩеУКЁЂЪЏгЭЕШЛЏЪЏШМСЯЪЭЗХГіДѓСПЕЊбѕЛЏЮяЃЈNOxЃЉЁЂCO2ЁЂSO2ЕШЦјЬхЃЌбЯжиЮлШОПеЦјЁЃЖдЗЯЦјНјааЭбЯѕЁЂЭбЬМКЭЭбСђДІРэПЩЪЕЯжТЬЩЋЛЗБЃЁЂЗЯЮяРћгУЁЃ
ЂёЃЎЭбЬМЃК
Яђ2LУмБеШнЦїжаМгШы2mol CO2ЁЂ8mol H2ЃЌдкЪЪЕБЕФДпЛЏМСзїгУЯТЃЌЗЂЩњЗДгІЃКCO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
ЃЈ1ЃЉИУЗДгІздЗЂНјааЕФЬѕМўЪЧ_______ЃЈЬюЁАЕЭЮТЁБЁЂЁАИпЮТЁБЛђЁАШЮвтЮТЖШЁБЃЉ
ЃЈ2ЃЉЯТСаа№ЪіФмЫЕУїДЫЗДгІДяЕНЦНКтзДЬЌЕФЪЧ_______________ЁЃ
aЁЂЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПБЃГжВЛБф
bЁЂCO2КЭH2ЕФЬхЛ§ЗжЪ§БШЮЊ1Љs4
cЁЂCO2КЭH2ЕФзЊЛЏТЪЯрЕШ
dЁЂЛьКЯЦјЬхЕФУмЖШБЃГжВЛБф
eЁЂ1mol CO2ЩњГЩЕФЭЌЪБга4mol H-HМќЖЯСб
ЂђЃЎЭбЯѕЃК
ЃЈ3ЃЉДпЛЏМСДцдкЯТЃЌH2ЛЙдNO2ЩњГЩЫЎеєЦјКЭЦфЫќЮоЖОЮяжЪЕФЛЏбЇЗНГЬЪНЮЊ__________ЁЃ
ЃЈ4ЃЉЮТЖШЮЊT1ЪБЃЌдкШ§ИіШнЛ§ОљЮЊ1LЕФКуШнУмБеШнЦїжаНіЗЂЩњЗДгІЃК2NO2(g) ![]() 2NO(g)+O2(g)ЯрЙиЪ§ОнШчЯТБэЫљЪОЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ__________ЁЃ
2NO(g)+O2(g)ЯрЙиЪ§ОнШчЯТБэЫљЪОЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ__________ЁЃ
ШнЦї БрКХ | ЮяжЪЕФЦ№ЪМХЈЖШ (molЁЄL-1) | ЮяжЪЕФЦНКтХЈЖШ (molЁЄL-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Мз | 0.6 | 0 | 0 | 0.2 |
вв | 0.3 | 0.5 | 0.2 | |
Бћ | 0 | 0.5 | 0.35 | |
AЃЎШнЦїМзжаЗЂЩњЗДгІЕФЦНКтГЃЪ§ЮЊ0.8
BЃЎШнЦїввжаЦ№ЪМЪБЗДгІе§ЯђНјаа
CЃЎДяЕНЦНКтЪБЃЌШнЦїБћжаc(O2)/c(NO2)>1
DЃЎДяЕНЦНКтЪБЃЌШнЦїМзгыШнЦїБћжаЕФзмбЙЧПжЎБШЮЊ16ЁУ17
ЁОД№АИЁПЕЭЮТ aЁЂe 4H2+2NO2![]() N2+4H2O D
N2+4H2O D
ЁОНтЮіЁП
ЃЈ1ЃЉздЗЂНјааЕФХаЖЯИљОнЪЧЁїH-TЁїSЃМ0ЃЌНсКЯЗДгІЬиеїЗжЮіХаЖЯашвЊЕФЬѕМўЃЛ
ЃЈ2ЃЉЗДгІЕНДяЦНКтЪБЃЌе§ФцЗДгІЫйТЪЯрЕШЃЌИїзщЗжЕФХЈЖШЁЂКЌСПВЛБфЃЌгЩДЫбмЩњЕФЦфЫќвЛаЉЮяРэСПВЛБфЃЌХаЖЯЦНКтЕФЮяРэСПгІЫцЗДгІНјааЗЂЩњБфЛЏЃЌИУЮяРэСПгЩБфЛЏЕНВЛБфЛЏЃЌЫЕУїЕНДяЦНКтЃЎ
ЃЈ3ЃЉДпЛЏМСДцдкЯТЃЌH2ЛЙдNO2ЩњГЩЫЎеєЦјКЭЦфЫќЮоЖОЮяжЪЃЌдЊЫиЪиКуПЩжЊЮоЖОЮяжЪЮЊN2ЃЌМДПЩЕУЕНЗДгІЗНГЬЪНЃЛ
ЃЈ4ЃЉA.ЦНКтГЃЪ§ЮЊЃЌЦНКтЪБПЬЩњГЩЮяХЈЖШУнжЎЛ§БШЩЯЗДгІЮяХЈЖШУнжЎЛ§ЃЛB.ХаЖЯЗДгІЯђФФИіЗНЯђНјааЃЌвЊМЦЫуQcЃЌШєQc=KЃЌдђЮЊЦНКтзДЬЌЃЌШєQc<KЃЌЗДгІе§ЯђНјааЃЌЗДжЎЗДгІФцЯђНјааЃЛC.ИљОнШ§ЖЮЪНЃЌЧѓГіc(O2)КЭc(NO2)ЃЌдкНјаазіБШЃЛD.гЩАЂЗќМгЕТТоЖЈТЩПЩжЊЃЌбЙЧПжЎБШЕШгкЮяжЪЕФСПжЎБШЃЌМЦЫуГіЮяжЪЕФСПЃЌМДПЩЕУЕНбЙЧПЕФЙиЯЕЃЛ
ЃЈ1ЃЉCO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)ЃЌьиБфЁїSЃМ0ЃЌЕЭЮТЯТТњзуЁїH-TЁїSЃМ0ЃЌЙЪИУЗДгІздЗЂНјааЕФЬѕМўЪЧЕЭЮТ
CH4(g)+2H2O(g)ЃЌьиБфЁїSЃМ0ЃЌЕЭЮТЯТТњзуЁїH-TЁїSЃМ0ЃЌЙЪИУЗДгІздЗЂНјааЕФЬѕМўЪЧЕЭЮТ
ЃЈ2ЃЉЯђ2LУмБеШнЦїжаМгШы2mol CO2ЁЂ8mol H2ЃЌЗЂЩњЗДгІЃКCO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
a.НЈСЂЦНКтЙ§ГЬжаЃЌЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПБфДѓЃЌЕБДяЕНЦНКтЪБЃЌЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПВЛБфЃЌФГвЛЪБПЬЃЌЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПБЃГжВЛБфЃЌдђДяЕНСЫЦНКтзДЬЌ,ЙЪaе§ШЗЃЛb.CO2КЭH2ЕФЬхЛ§ЗжЪ§БШКуЮЊ1Љs4ЃЌЮоЗЈХаЖЯЪЧЗёДяЕНЦНКтзДЬЌЃЌЙЪbДэЮѓЃЛc.Яђ2LУмБеШнЦїжаМгШы2mol CO2ЁЂ8mol H2ЃЌЗЂЩњЗДгІЃКCO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)ЃЌCO2КЭH2АДее1ЃК4ЗДгІЃЌCO2КЭH2ЕФзЊЛЏТЪЪМжеЯрЕШЃЌВЛФмШЗЖЈЗДгІЪЧЗёДяЕНЦНКтзДЬЌЃЌcДэЮѓЃЛd.ЛьКЯЦјЬхЕФУмЖШІб=m/vЃЌгЩжЪСПЪиКуПЩжЊЃЌmВЛБфЃЌ2LУмБеШнЦїЃЌvВЛБфЃЌЙЪІбЪМжеВЛБфЃЌВЛФмШЗЖЈЗДгІЪЧЗёДяЕНЦНКтзДЬЌЃЌdДэЮѓЃЛe.га4mol H-HМќЖЯСбЪБЃЌЯћКФ4molH2ЃЌЩњГЩ1mol CO2ЕШЭЌгкЩњГЩ4molH2ЃЌЯћКФ4molH2ЕФЭЌЪБЃЌгжЩњГЩЯћКФ4molH2ЃЌЗДгІДяЕНСЫЦНКтзДЬЌЃЌЙЪeе§ШЗЁЃзлЩЯЃЌБОЬтбЁaЁЂeЁЃ
CH4(g)+2H2O(g)ЃЌCO2КЭH2АДее1ЃК4ЗДгІЃЌCO2КЭH2ЕФзЊЛЏТЪЪМжеЯрЕШЃЌВЛФмШЗЖЈЗДгІЪЧЗёДяЕНЦНКтзДЬЌЃЌcДэЮѓЃЛd.ЛьКЯЦјЬхЕФУмЖШІб=m/vЃЌгЩжЪСПЪиКуПЩжЊЃЌmВЛБфЃЌ2LУмБеШнЦїЃЌvВЛБфЃЌЙЪІбЪМжеВЛБфЃЌВЛФмШЗЖЈЗДгІЪЧЗёДяЕНЦНКтзДЬЌЃЌdДэЮѓЃЛe.га4mol H-HМќЖЯСбЪБЃЌЯћКФ4molH2ЃЌЩњГЩ1mol CO2ЕШЭЌгкЩњГЩ4molH2ЃЌЯћКФ4molH2ЕФЭЌЪБЃЌгжЩњГЩЯћКФ4molH2ЃЌЗДгІДяЕНСЫЦНКтзДЬЌЃЌЙЪeе§ШЗЁЃзлЩЯЃЌБОЬтбЁaЁЂeЁЃ
ЃЈ3ЃЉДпЛЏМСДцдкЯТЃЌH2ЛЙдNO2ЩњГЩЫЎеєЦјКЭЦфЫќЮоЖОЮяжЪЃЌдЊЫиЪиКуПЩжЊЮоЖОЮяжЪЮЊN2ЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊ4H2+2NO2![]() N2+4H2O
N2+4H2O
ЃЈ4ЃЉМзШнЦїжа2NO2(g) ![]() 2NO(g) + O2(g)
2NO(g) + O2(g)
C0 0.6molЁЄL-1 0molЁЄL-1 0molЁЄL-1
ІЄC 0.4molЁЄL-1 0.4molЁЄL-1 0.2molЁЄL-1
CЦН 0.2molЁЄL-1 0.4molЁЄL-1 0.2molЁЄL-1
A.ИљОнЬтИЩПЩСаГіШнЦїМзжаЕФШ§ЖЮЪНЃЌK=c2(NO)ЁСc(O2)/c2(NO2)=0.8ЃЌЙЪAЯюе§ШЗЃЛB.ввШнЦїжаQc=c2(NO)ЁСc(O2)/c2(NO2)=0.56<0.8ЃЌЙЪДЫЪБЗДгІе§ЯђНјааЃЌBЯюе§ШЗЃЛC.ЩшДяЕНЦНКтЪБЃЌЯћКФO2ЕФХЈЖШЪЧxmol/LЁЃ
БћШнЦїжа2NO2(g) ![]() 2NO(g) + O2(g)
2NO(g) + O2(g)
C0 0molЁЄL-1 0.5molЁЄL-1 0.35molЁЄL-1
ІЄC 2x molЁЄL-1 2x molЁЄL-1 x molЁЄL-1
CЦН 2x molЁЄL-1 (0.5-2x) molЁЄL-1 (0.35-x) molЁЄL-1
K=c2(NO)ЁСc(O2)/c2(NO2)=(0.5-2x)2(0.35-x)/(2x)2=0.8ЃЌНтЕУx=0.09molЃЌЙЪO2=0.26mol ЃЌNO2=0.18molЃЌc(O2)/c(NO2)=0.26/0.18>1ЃЌЙЪCе§ШЗЃЛD.гЩШ§ЖЮЪНПЩжЊЃЌЦНКтЪБЃЌМзШнЦїжаЦјЬхЕФзмЮяжЪЕФСПnзм=(c(NO2)+c(NO)+c(O2)ЃЉЁСV=0.8molЃЌБћШнЦїжаЦјЬхЕФзмЮяжЪЕФСПn


 53ЫцЬУВтЯЕСаД№АИ
53ЫцЬУВтЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕСГЪвШЁЕШЮяжЪЕФСПЕФKClO3ЗжБ№ЗЂЩњЯТЪіЗДгІЃК
ЗДгІвЛЃКгаДпЛЏМСДцдкЪБЃЌЪмШШЗжНтЕУЕНбѕЦјЃЛ
ЗДгІЖўЃКВЛЪЙгУДпЛЏМСЃЌМгШШжС743KзѓгвЃЌЕУЕНKClO4КЭKClЁЃ
ЯТСаЙигкЂйКЭЂкЕФЫЕЗЈе§ШЗЕФЪЧ( )
A. СНИіЗДгІжаЖМжЛгавЛжждЊЫиЛЏКЯМлЗЂЩњИФБф
B. СНИіЙ§ГЬЩњГЩKClЕФЮяжЪЕФСПЯрЭЌ
C. ЗЂЩњбѕЛЏЗДгІЕФдЊЫиЯрЭЌ
D. ЗЂЩњЛЙдЗДгІЕФдЊЫиЯрЭЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЙигкШШЛЏбЇЗДгІЕФУшЪіжае§ШЗЕФЪЧ
A. HClКЭNaOHЗДгІЕФжаКЭШШЁїHЃНЃ57.3 kJЁЄmol1ЃЌдђH2SO4КЭCa(OH)2ЗДгІЕФжаКЭШШЁїH=2ЁС(Ѓ57.3)kJЁЄmol1
B. МзЭщЕФБъзМШМЩеШШІЄHЃНЃ890.3 kJЁЄmol1ЃЌдђCH4(g)ЃЋ2O2(g)ЃНCO2(g)ЃЋ2H2O(g) ІЄHЃМЃ890.3 kJЁЄmol1
C. вбжЊЃК500ЁцЁЂ30MPaЯТЃЌN2(g)ЃЋ3H2(g)![]() 2NH3(g) ІЄHЃНЃ92.4kJЁЄmolЃ1ЃЛНЋ1.5 mol H2КЭЙ§СПЕФN2дкДЫЬѕМўЯТГфЗжЗДгІЃЌЗХГіШШСП46.2 kJ
2NH3(g) ІЄHЃНЃ92.4kJЁЄmolЃ1ЃЛНЋ1.5 mol H2КЭЙ§СПЕФN2дкДЫЬѕМўЯТГфЗжЗДгІЃЌЗХГіШШСП46.2 kJ
D. CO(g)ЕФШМЩеШШЪЧ283.0kJЁЄmol1ЃЌдђ2CO2(g) ===2CO(g)+O2(g)ЗДгІЕФЁїHЃН+566.0 kJЁЄmol1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЭЈГЃЧщПіЯТЃЌМШФмгУХЈСђЫсИЩдяЃЌгжФмгУМюЪЏЛвИЩдяЕФЪЧЃЈ ЃЉ
A. NOB. Cl2C. NH3D. HCl
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПHЁЂDЁЂT Ш§жжЭЌЮЛЫиОпгаВЛЭЌЕФЃЈ ЃЉ
A.жЪзгЪ§B.жазгЪ§C.КЫЕчКЩЪ§D.ЕчзгЪ§
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛЖЈЬѕМўЯТЃЌдкШнЛ§ЮЊ2LЕФУмБеШнЦїжаЃЌНЋ2 mol ЦјЬхMКЭ3 mol NЦјЬхЛьКЯЃЌЗЂЩњШчЯТЗДгІЃК2M(g)ЃЋ3N(g)![]() xQ(g)ЃЋ3R(g)ЃЌИУЗДгІДяЦНКтЪБЃЌЩњГЩ2.4mol RЃЌВЂВтЕУQЕФХЈЖШЮЊ0.4 mol/LЃЌЯТСагаЙиа№Ъіе§ШЗЕФЪЧ
xQ(g)ЃЋ3R(g)ЃЌИУЗДгІДяЦНКтЪБЃЌЩњГЩ2.4mol RЃЌВЂВтЕУQЕФХЈЖШЮЊ0.4 mol/LЃЌЯТСагаЙиа№Ъіе§ШЗЕФЪЧ
A. xжЕЮЊ2 B. ЛьКЯЦјЬхЕФУмЖШдіДѓ
C. NЕФзЊЛЏТЪЮЊ80% D. ЛьКЯЦјЬхЦНОљФІЖћжЪСПВЛБфЃЌВЛФмЫЕУїИУЗДгІДяЦНКт
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвдЭвјКЯН№(КЌЩйСПЬњ)ЗЯСЯЮЊдСЯЛиЪевјКЭЭЕФЙЄвеСїГЬШчЯТЃК

ЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. ДжЭШмгкЙ§СПЯЁЯѕЫсЃЌЙ§ТЫЁЂЕЭЮТИЩдяЕУДПЭ
B. ЕчНтЪБгУДжвјзївѕМЋЃЌЯѕЫсвјШмвКЮЊЕчНтжЪШмвК
C. гУЯЁСђЫсДІРэдќСЯЪБжївЊЗЂЩњСЫбѕЛЏЛЙдЗДгІ
D. ДгТЫвКBжаПЩвдЬсШЁТЬЗЏ(FeSO4ЁЄ7H2O)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЁАТЬЫЎЧрЩНОЭЪЧН№ЩНвјЩНЁБЃЌвђДЫбаОПNOxЁЂSO2ЕШДѓЦјЮлШОЮяЕФЭзЩЦДІРэОпгаживЊвтвхЁЃ
(1)SO2ЕФХХЗХжївЊРДздгкУКЕФШМЩеЃЌЙЄвЕЩЯГЃгУАБЫЎЮќЪеЗЈДІРэЮВЦјжаЕФSO2ЁЃвбжЊЮќЪеЙ§ГЬжаЯрЙиЗДгІЕФШШЛЏбЇЗНГЬЪНШчЯТЃК
ЂйSO2(g)+NH3ЁЄH2O(aq)==NH4HSO3(aq) ЁїH1=akJЁЄmolЃ1ЃЛ
ЂкNH3ЁЄH2O(aq)+NH4HSO3(aq)==(NH4)2SO3(ag)+H2O(l) ЁїH2=bkJЁЄmolЃ1ЃЛ
Ђл2(NH4)2SO3(aq)+O2(g)==2(NH4)2SO4(aq) ЁїH3=ckJЁЄmolЃ1ЁЃ
дђЗДгІ2SO2(g)+4NH3ЁЄH2O(aq)+O2(g)==2(NH4)2SO4(aq)+2H2O(1)ЕФЁїH=___________kJЁЄmolЃ1ЁЃ
(2)ШМУКЗЂЕчГЇГЃРћгУЗДгІ2CaCO3(s)+2SO2(g)+O2(g)===2CaSO4(s)+2CO2(g)
ЁїH=Ѓ681.8kJЁЄmolЃ1ЖдУКНјааЭбСђДІРэРДМѕЩйSO2ЕФХХЗХЁЃЖдгкИУЗДгІЃЌдкTЁцЪБЃЌНшжњДЋИаЦїВтЕУЗДгІдкВЛЭЌЪБМфЕуЩЯИїЮяжЪЕФХЈЖШШчЯТЃК
0 | 10 | 20 | 30 | 40 | 50 | |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
Ђй0~10minФкЃЌЦНОљЗДгІЫйТЪv(O2)___________molЁЄLЃ1ЁЄminЃ1ЃЛЕБЩ§ИпЮТЖШЃЌИУЗДгІЕФЦНКтГЃЪ§K___________(ЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБ)ЁЃ
Ђк30minКѓЃЌжЛИФБфФГвЛЬѕМўЃЌЗДгІжиаТДяЕНЦНКтЁЃИљОнЩЯБэжаЕФЪ§ОнХаЖЯЃЌИФБфЕФЬѕМўПЩФмЪЧ___________(ЬюзжФИ)ЁЃ
AМгШывЛЖЈСПЕФЗлзДЬМЫсИЦ BЭЈШывЛЖЈСПЕФO2
CЪЪЕБЫѕаЁШнЦїЕФЬхЛ§ DМгШыКЯЪЪЕФДпЛЏМС
(3) NOxЕФХХЗХжївЊРДздгкЦћГЕЮВЦјЃЌШЫРћгУЗДгІ
C(s)+2NO(g)![]() N2(g)+CO2(g) ЁїH=Ѓ34.0kJЁЄmolЃ1ЃЌгУЛюадЬПЖдNOНјааЮќИНЁЃвбжЊдкУмБеШнЦїжаМгШызуСПЕФCКЭвЛЖЈСПЕФNOЦјЬхЃЌБЃГжКубЙВтЕУNOЕФзЊЛЏТЪЫцЮТЖШЕФБфЛЏШчЭМЫљЪОЃК
N2(g)+CO2(g) ЁїH=Ѓ34.0kJЁЄmolЃ1ЃЌгУЛюадЬПЖдNOНјааЮќИНЁЃвбжЊдкУмБеШнЦїжаМгШызуСПЕФCКЭвЛЖЈСПЕФNOЦјЬхЃЌБЃГжКубЙВтЕУNOЕФзЊЛЏТЪЫцЮТЖШЕФБфЛЏШчЭМЫљЪОЃК
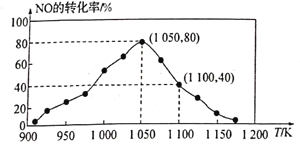
гЩЭМПЩжЊЃЌ1050KЧАЗДгІжаNOЕФзЊЛЏТЪЫцЮТЖШЩ§ѓ{ЖјдіДѓЃЌЦфдвђЮЊ____________________ЃЛдк1100KЪБЃЌCO2ЕФЬхЛ§ЗжЪ§ЮЊ___________ЁЃ
(4)гУФГЮяжЪЕФЦНКтЗжбЙДњЬцЦфЮяжЪЕФСПХЈЖШвВПЩвдБэЪОЛЏбЇЦНКтГЃЪ§(МЧзїKp)ЁЃдк1050KЁЂ1.1ЁС106PaЪБЃЌИУЗДгІЕФЛЏбЇЦНКтГЃЪ§Kp=___________[вбжЊЃКЦјЬхЗжбЙ(PЗж)=ЦјЬхзмбЙ(Pa)ЁСЬхЛ§ЗжЪ§]ЁЃ
(5)ЮЊБмУтЦћГЕЮВЦјжаЕФгаКІЦјЬхЖдДѓЦјЕФЮлШОЃЌашИјЦћГЕАВзАЮВЦјОЛЛЏзАжУЁЃдкОЛЛЏзАжУжаCOКЭNOЗЂЩњЗДгІ2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ЁїH=Ѓ746.8kЁЄmolЃ1ЃЌЩњГЩЮоЖОЕФN2КЭCO2ЁЃЪЕбщВтЕУЃЌvе§=kе§ЁЄc2(NO)ЁЄc2(CO)ЃЌvФц=kФцЁЄc(N2) ЁЄc2(CO2)(kе§ЁЂkФцЮЊЫйТЪГЃЪ§ЃЌжЛгыЮТЖШгаЙи)ЁЃ
N2(g)+2CO2(g) ЁїH=Ѓ746.8kЁЄmolЃ1ЃЌЩњГЩЮоЖОЕФN2КЭCO2ЁЃЪЕбщВтЕУЃЌvе§=kе§ЁЄc2(NO)ЁЄc2(CO)ЃЌvФц=kФцЁЄc(N2) ЁЄc2(CO2)(kе§ЁЂkФцЮЊЫйТЪГЃЪ§ЃЌжЛгыЮТЖШгаЙи)ЁЃ
ЂйДяЕНЦНКтКѓЃЌНіЩ§ИпЮТЖШЃЌkе§діДѓЕФБЖЪ§___________(ЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБ)kФцдіДѓЕФБЖЪ§ЁЃ
ЂкШєдк1LЕФУмБеШнЦїжаГфШы1 molCOКЭ1 molNOЃЌдквЛЖЈЮТЖШЯТДяЕНЦНКтЪБЃЌCOЕФзЊЛЏТЪЮЊ40%ЃЌдђ![]() =___________ЁЃ
=___________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉЗЂЩфЮРаЧЕФЛ№М§ЭЦНјЦїжаДѓЖрЪЙгУШМСЯЦЋЖўМзыТЃЌЦфЛЏбЇЪНC2H8N2ЁЃЪдМЦЫуЃК
ЂйЦЋЖўМзыТЕФФІЖћжЪСПЪЧ________ЃЛ480 gЦЋЖўМзыТЕФЮяжЪЕФСПЮЊ________ЁЃ
ЂкЦЋЖўМзыТжаЬМдзггыЕЊдзгЕФИіЪ§жЎБШЪЧ________ЃЌЮяжЪЕФСПжЎБШЪЧ________ЃЛ1 molЦЋЖўМзыТжаКЌгаЕФЧтдзгЪ§ФПЪЧ________ЁЃ
ЃЈ2ЃЉОнБЈЕРЃЌМгРћИЃФсбЧДѓбЇЕФПЦбаШЫдБЗЂЯжСЫЪРНчЩЯзюЧПЕФЫсЁЃетжжЧПЫсЕФЛЏбЇЪНЪЧCHB11Cl11ЁЃЦфжа11ИіХ№дзгКЭ1ИіЬМдзгХХСаГЩ20УцЬхЃЌетЪЧФПЧАЛЏКЯЮяжаЛЏбЇаджЪзюЮЊЮШЖЈЕФдзгзщКЯЁЃЧыЛиД№ЯТСаЮЪЬтЃК
ЂйетжжГЌЧПЫсгЩ________жждЊЫизщГЩЁЃ
ЂкгУNAБэЪОАЂЗќМгЕТТоГЃЪ§ЕФЪ§жЕЃЌФЧУД1 molИУГЌЧПЫсжаКЌгаЕФТШдзгЪ§ФПЮЊ________ЃЌШєГЦШЁИУГЌЧПЫс1 049 gЃЌдђЦфжаКЌХ№дзгЕФЪ§ФПЮЊ________ЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com