
某温度时,在2L容器中,某一反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
(1)在4min末时,A、B的物质的量浓度c(A) c(B),从0~4min内A、B的物质的量浓度变化量△c(A) △c(B)(以上填“>”“<”或“=”).
(2)从反应开始至4min时,A的平均反应速率为 .
(3)该反应的化学方程式为 .
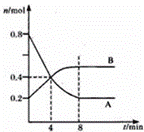
| 物质的量或浓度随时间的变化曲线. | |
| 专题: | 化学平衡专题. |
| 分析: | (1)根据图象可知,在4min末时,A、B的物质的量浓度均为0.2mol/L,从0~4min内A、B的物质的量浓度变化量△c(A)=0.4mol/L﹣0.2mol/L=0.2mol/L,△c(B)=0.2mol/L﹣0.1mol/L=0.2mol/L,故△c(A)>△c(B),据此判断; (2)根据v= (3)根据参加反应的物质的物质的量浓度变化之比等于化学计量数之比书写化学方程式. |
| 解答: | 解:(1)根据图象可知,在4min末时,A、B的物质的量浓度均为0.2mol/L,从0~4min内A、B的物质的量浓度变化量△c(A)=0.4mol/L﹣0.2mol/L=0.2mol/L,△c(B)=0.2mol/L﹣0.1mol/L=0.2mol/L,故△c(A)>△c(B),故答案为:=;>; (2)反应开始至4min时,A的平均反应速率为:v= 故答案为:0.05mol/(L•min); (3)由图象可知,A的物质的量逐渐减小,应为反应物,B的物质的量逐渐增加,应为生成物,参加反应的物质的物质的量之比等于化学计量数之比, 则n(A):n(B)=(0.8mol﹣0.4mol):(0.4mol﹣0.2mol)=2:1,所以反应的化学方程式为:2A |
| 点评: | 本题考查化学反应速率变化曲线及应用和转化率的计算,题目难度不大,注意分析图象曲线的变化趋势,把握化学平衡状态的特征. |


科目:高中化学 来源: 题型:
把10.2g 镁铝合金的粉末放入过量的盐酸中,得到11.2L H2(标准状况下).试计算:
(1)该合金中铝的质量分数;
(2)该合金中铝和镁的物质的量之比.
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 mol氢气完全燃烧生成水蒸气时放出能量242 kJ,拆开1 mol氧气中的化学键需要吸收能量496 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ。计算氢气中1 mol H—H键断裂时吸收多少能量?
查看答案和解析>>
科目:高中化学 来源: 题型:
在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速度最快的是( )
|
| A. | V(NH3)=0.1mol/(L•min) | B. | V(N2)=0.1mol/(L•min) |
|
| C. | V(N2)=0.2mol/(L•min) | D. | V(H2)=0.3mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )
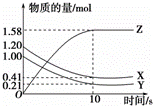
|
| A. | 反应开始到10s,用Z表示的反应速率为0.158mol/(L•s) |
|
| B. | 反应开始到10s,X的物质的量浓度减少了0.79mol/L |
|
| C. | 达平衡时Y的物质的量分数为:9.5% |
|
| D. | 反应的化学方程式为:X(g)+Y(g)⇌Z(g) |
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高一上学期期末考试化学试卷(解析版) 题型:实验题
(8分)某学生做浓硫酸性质的实验:
在一支试管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有NaOH溶液的棉花。加热试管,观察现象。
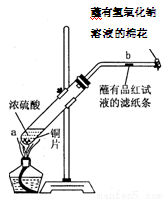
回答下列问题:
(1)写出试管中发生反应的化学方程式 。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为 ,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为 。
(3)蘸有NaOH溶液的棉花团作用是 。
(4)硫酸型酸雨的形成过程可用下列反应中的 来表示。
A:O2+H2O H2SO3
H2SO3
B:O2+2H2SO3=2H2SO4
C:SO2+H2O2=H2SO4
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列关于SO2的叙述,正确的是
A.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物
B.SO2是硫酸的酸酐
C.大气中SO2的主要来源是汽车排出的尾气
D.SO2具有漂白性,因而可以使石蕊试液褪色
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列叙述不正确的是
A.工业上可用碳在高温下还原二氧化硅制取硅。
B.工业上可用氯气和石灰乳为原料制造漂白粉。
C.镁条不能在二氧化碳气体中燃烧。
D.将盛有氢氧化铁胶体的烧杯置于暗处,用一束光照射,从垂直于光线的方向可以观察到一条光亮的通路。
查看答案和解析>>
科目:高中化学 来源:2014-2015宁夏银川市高一下学期3月月考化学试卷(解析版) 题型:选择题
在100mL混合酸的溶液中,硝酸的物质的量浓度为0.4mol/L,硫酸的物质的量浓度为0.2mol/L,向其中加入6.4g铜粉,微热,使其充分反应。生成NO的物质的量
A. 0.01mol B. 0.02mol C. 0.03mol D. 0.04mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com