
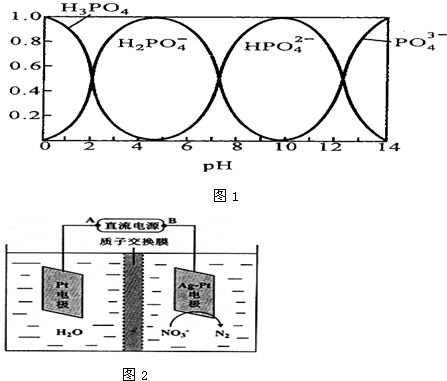
| c(Na+) |
| c(PO43-) |
| 3 |
| 2 |
| 3 |
| 2 |
| c(Na+) |
| c(PO43-) |
| c(HP042-)×c(OH-) |
| c(PO43-) |
| 0.01×0.01 |
| 0.09 |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
| A、原子半径的大小顺序:rX>rY>rW>rQ |
| B、X、Y的最高价氧化物的水化物之间不能发生反应 |
| C、元素Q和Z能形成QZ2型的共价化合物 |
| D、Z元素的氢化物稳定性大于W元素的氢化物稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用铜作电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| B、0.01mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合:A13++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | ||||
| C、少量二氧化硫通入次氯酸钠碱性溶液中:SO2+ClO-+2OH-═SO42-+Cl-+H2O | ||||
| D、Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
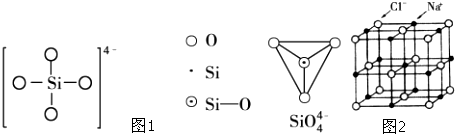
| 电离能/kJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
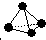 ,已知断裂1mol N-N键吸收167kJ的热量,生成1mol N≡N键放出942kJ热量.试判断相同条件下N4与N2的稳定性顺序是:
,已知断裂1mol N-N键吸收167kJ的热量,生成1mol N≡N键放出942kJ热量.试判断相同条件下N4与N2的稳定性顺序是:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,106g碳酸钠固体所含有的离子总的物质的量小于3mol |
| B、在同压不同温的情况下,质量相同的氧气和臭氧所含氧原子数不相同 |
| C、将物质的量浓度分别为1mol/L和2mol/L的硫酸等质量混合(假设体积可以加和),则混合后硫酸溶液的浓度为1.5mol/L |
| D、标况下,22.4L CH3Cl分子数约为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
| A、实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率v(N)=1.0×10-2mol/(L?min) |
| B、实验②中,该反应的平衡常数K=2.0 |
| C、实验③中,达到平衡时,X的转化率为60% |
| D、实验④中,达到平衡时,b>0.060 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、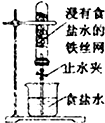 一段时间后打开止水夹,观察到导管中液面上升,因为铁发生了吸氧腐蚀 |
B、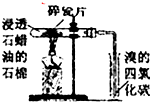 加热一段时间,观察到溴的四氯化碳溶液颜色褪去,因为有气态烯烃产生 |
C、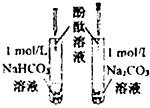 溶液均变红,碳酸钠溶液颜色较深,因为相同条件下水解能力HCO3-强于CO32- |
D、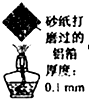 加热一段时间,观察到熔化的铝未滴落,因为铝表面生成氧化铝的熔点很高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com