
| A. | 10 mL 20 mol•L-1 浓硫酸与足量锌反应,转移电子数为 0.2NA | |
| B. | 0.1 mol24Mg18O 晶体中所含中子总数为 2.0 NA | |
| C. | 在标准状况下,2.8g N2 和 2.24L CO 所含电子数均为 1.4NA | |
| D. | 1 L 1 mol•L-1 的 NaClO 溶液中含有 ClO-的数目为NA |
分析 A、12.5mL 16mol/L的浓硫酸中含有0.2mol硫酸,与锌反应时先生成二氧化硫,等硫酸变稀时后生成氢气.
B、中子数=质量数-质子数,1mol24Mg18O中含有的中子物质的量为(24-12)+(18-8)=22mol,根据N=nNA计算中子数目.
C、氮气分子和一氧化碳分子是等电子体,且分子量相同,所以可以把混合物当作一种物质进行计算,根据气体的物质的量和分子的构成计算电子数;
D、ClO-是弱酸根,在溶液中会水解.
解答 解:A、10mL 20mol/L的浓硫酸中含有0.2mol硫酸,与锌反应时先是硫元素被还原生成二氧化硫:Zn+SO42-+4H+=Zn2++SO2↑+2H2O,此时当反应掉4mol氢离子时,转移2mol电子;如果氢离子有剩余,锌和氢离子再反应:Zn+2H+=Zn2++H2↑,此反应中2mol氢离子转移2mol电子,而溶液中共0.4mol氢离子,故转移的电子数介于0.2NA和0.4NA之间,故A错误;
B、1mol24Mg18O中含有的中子物质的量为(24-12)+(18-8)=22mol,0.1 mol24Mg18O晶体中所含中子总数为0.1×22mol×NAmol-1=2.2NA,故B错误;
C、一个氮气分子或一氧化碳分子中都含有14的电子,氮气和一氧化碳的摩尔质量相等,所以可把两种物质当成一种物质进行计算,2.8 g N2和2.8 g CO的物质的量都是0.1mol,含有的电子数都是1.4 NA,故C正确;
D、ClO-是弱酸根,在溶液中会水解,故溶液中ClO-的个数小于NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 13、1 | B. | 13、2 | C. | 11、1 | D. | 10、2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | CO2+H2O═H2CO3 | ||
| C. | Fe+H2SO4=FeSO4+H2↑ | D. | MgCO3+2HCl═2HCl2+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
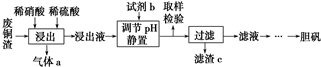

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的表述不正确的是( )
的表述不正确的是( )| A. | 该物质能发生加成、取代、氧化反应 | |
| B. | 该物质遇FeC13溶液显色,lmol该物质遇浓溴水时最多与1mo1Br2发生取代反应 | |
| C. | 该物质的分子式为C11H14O3 | |
| D. | 1mol该物质最多消耗Na,NaOH,NaHC03的物质的量之比为2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阿伏加德罗常数的数值与12g 12C所含的碳原子数相等 | |
| B. | 在0.5mol Na2SO4 中,含有的Na+ 数约是6.02×1023 | |
| C. | 等物质的量的O2 与O3,所含氧原子数相等 | |
| D. | 摩尔是物质的量的单位 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com